海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
| 成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
| 含量/mg·L-1 | 9 360 | 83 | 200 | 1 100 | 16 000 | 1 200 | 118 |
(1)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过。
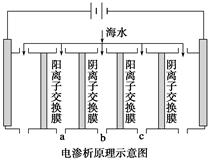
①阴极的电极反应式为__________________。
②电解一段时间,阴极区会产生水垢,其成分为CaCO3和Mg(OH)2,写出生成CaCO3的离子方程式______________________________________。
③淡水的出口为a、b、c中的________出口。
(2)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如下图所示:
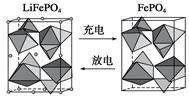
该电池电解质为传导Li+的固体材料。放电时该电极是电池的________极(填“正”或“负”),电极反应式为______________________。
(1)①2H2O+2e-=H2↑+2OH-
②Ca2++OH-+HCO3-=CaCO3↓+H2O
③b
(2)正 FePO4+e-+Li+=LiFePO4
(1)①电解海水,阴极是H+得电子,而不是活泼金属阳离子,2H2O+2e-=H2↑+2OH-。
②由于在阴极区H+不断放电,破坏水的电离平衡,c(OH-)增大,致使Ca2++OH-+HCO3-=CaCO3↓+H2O。
③因为在阴极区除去Ca2+、Mg2+,所以淡水应b口出。
(2)放电时的电极反应式分别为负极:Li-e-=Li+,
正极:FePO4+Li++e-=LiFePO4。

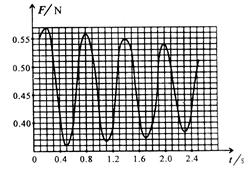
 s 时摆球正经过最高点
s 时摆球正经过最高点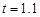 s 时摆球正经过最低点
s 时摆球正经过最低点