臭氧是一种强氧化剂,常用于消毒、灭菌等。
(1)O3与KI溶液反应生成的两种单质是________和________(填分子式)。
(2)O3在水中易分解,一定条件下,O3的浓度减少一半所需的时间(t)如下表所示。已知:O3的起始浓度为0.0216 mol/L。
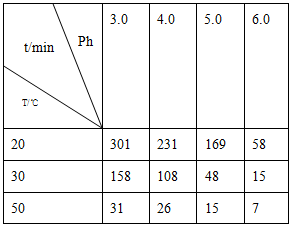
①pH增大能加速O3分解,表明对O3分解起催化作用的是________。
②在30℃、pH=4.0条件下,O3的分解速率为________mol/(L·min)。
③据表中的递变规律,推测O3在下列条件下分解速率依次增大的顺序为________(填字母代号)。
a.40℃、pH=3.0 b.10℃、pH=4.0
c.30℃、pH=7.0
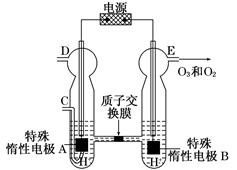
(3)O3可由臭氧发生器(原理如图)电解稀硫酸制得。
①图中阴极为________(填“A”或“B”),其电极反应式为_______________________。
②若C处通入O2,则A极的电极反应式为________。
③若C处不通入O2,D、E处分别收集到x L和y L气体(标准状况),则E处收集的气体中O3所占的体积分数为________(忽略O3的分解)。
(1)I2 O2
(2)①OH- ②1.00×10-4 ③b、a、c
(3)①A 2H++2e-=H2↑
②O2+4H++4e-=2H2O ③(x-2y)/y
本题以臭氧为载体考查了化学反应速率、电化学等化学反应原理,同时考查了考生对图表的观察分析能力。
(1)臭氧具有氧化性,能与碘化钾发生氧化还原反应生成氧气、碘单质和氢氧化钾。
(2)30℃、pH=4.0时,臭氧分解一半所用时间为108 min,反应速率v=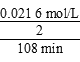 =1.00×10-4mol/(L·min);结合表中数据知反应速率在b条件下最小、c条件下最大。
=1.00×10-4mol/(L·min);结合表中数据知反应速率在b条件下最小、c条件下最大。
(3)观察电化学装置图知,特殊惰性电极B上产生了氧气和臭氧,该极失去电子发生氧化反应作阳极,则特殊惰性电极A为阴极,得电子发生还原反应,电极反应式为2H++2e-=H2↑;若从C处通入氧气,氧气将参与反应,阴极生成的将是水,电极反应为O2+4H++4e-=2H2O;设y L混合气体中臭氧的体积分数为a,由电子守恒有2x=y a×6+y(1-a)×4,解得a=(x-2y)/y。
