问题
填空题
近几年开发的甲醇燃料电池采用铂作电极催化剂,电池中的质子交换膜只允许质子和水分子通过。其工作原理的示意图如下:
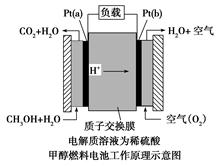
请回答下列问题:
(1)Pt(a)电极是电池的 极,电极反应式为 ;Pt(b)电极发生 反应(填“氧化”或“还原”),电极反应式为 。
(2)电池的总反应方程式为 。
(3)如果该电池工作时电路中通过2 mol电子,则消耗的CH3OH有 mol。
答案
(1)负 2CH3OH+2H2O-12e-=2CO2↑+12H+ 3O2+12H++12e-=6H2O
(2)2CH3OH+3O2=2CO2+4H2O
(3)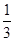
从示意图中可以看出电极Pt(a)原料是CH3OH和水,反应后产物为CO2和H+,CH3OH中碳元素化合价为-2,CO2中碳元素化合价为+4,说明Pt(a)电极上CH3OH失去电子,电极Pt(a)是负极,则电极Pt(b)是正极,Pt(b)电极原料是O2和H+,反应后的产物为H2O,氧元素化合价由0→-2,发生还原反应,因为电解质溶液是稀H2SO4,可以写出电池总反应式为2CH3OH+3O2=2CO2+4H2O,再写出较为简单的正极反应式:3O2+12e-+12H+=6H2O,用总反应式减去正极反应式即可得到负极反应式为:2CH3OH+2H2O-12e-=2CO2↑+12H+。
