I.常温下在20mL0.1mol/L Na2CO3溶液中逐滴加入0.1mol/L HCl溶液40mL,溶液的pH逐渐降低,此时溶液中含碳元素的微粒物质的量浓度的百分含量(纵轴)也发生变化(CO2因逸出未画出),如图所示。回答下列问题
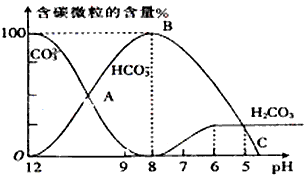
(1)H2CO3、HCO3-、CO32-中不能大量共存于同一溶液中的是___________________。
(2)实验室可用“双指示剂法”测定碳酸钠、碳酸氢钠混合溶液中各种物质的含量,操作步骤如下:
①取固体样品配成溶液;
②取25mL样品溶液加指示剂A,用0.1010mol/LNaOH标准溶液滴定至终点;
③再加指示剂B,再用0.1010mol/LNaOH标准溶液滴定至终点……
指示剂B的变色范围在pH=______左右最理想。
(3)当pH=7时,此时再滴入盐酸溶液所发生反应离子方程式是____________________。
(4)已知在25℃时,CO32-水解反应的平衡常数即水解常数Kh=2×10-4,当溶液中c(HCO3-)︰c(CO32-)=
2︰1时,溶液的pH=_____________。
II.某二元弱酸(简写为H2A)溶液,按下式发生一级和二级电离:H2A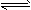 H++HA- HA-
H++HA- HA-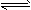 H++A2-
H++A2-
已知相同浓度时的电离度α(H2A)> α(HA-),设有下列四种溶液:
(A)0.01mol/L 的H2A溶液
(B)0.01mol/L 的NaHA溶液
(C)0.01mol/L 的HCl与0.04mol/L的NaHA溶液等体积混合液
(D)0.02mol/L 的NaOH与0.02 mol/L的NaHA溶液等体积混合液
据此,填写下列空白(填代号) :
(5)c(H+)最大的是_________,c(H2A)最大的是___________,c(A2-)最大的是_________。
(1)H2CO3、CO32-
(2)4.5
(3)HCO3-+H+=H2CO3
(4)10
(5)A;C;D
