设计新型燃料电池是本世纪最富有挑战性的课题之一。
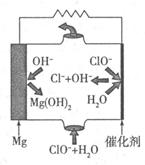
(1)有人制造了一种燃料电池,一个电极通入O2(含有少量CO2),另一个电极通入CH4,电池的电解质是熔融的K2CO3。该电池的负极反应式为____________________________,电池工作时,电解质里的CO(向________极移动(填“正”或“负”)。
(2)某科研小组依据甲醇燃烧的反应原理,设计如图10-3所示的原电池装置。该电池的负极反应式为________________________________________________,用该电池电解CuCl2溶液,当产生33.6 L Cl2(标准状况下)时,消耗甲醇的质量为________g。
(1)CH4+4CO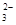 -8e-===5CO2+2H2O 负
-8e-===5CO2+2H2O 负
(2)CH3OH+8OH--6e-===CO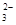 +6H2O 16
+6H2O 16
(1)CH4在负极放电,生成CO2和H2O,电极反应式为CH4+4CO-8e-===5CO2+2H2O;熔融电解质中的阴离子向负极移动。
(2)该燃料电池的总反应方程式为:2CH3OH+3O2+4OH-===2CO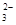 +6H2O……①,在碱性条件下正极的电极反应式为:O2+2H2O+4e-===4OH-……②,①-②×3得负极电极反应式为CH3OH+8OH--6e-===CO
+6H2O……①,在碱性条件下正极的电极反应式为:O2+2H2O+4e-===4OH-……②,①-②×3得负极电极反应式为CH3OH+8OH--6e-===CO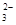 +6H2O。据电子守恒则有CH3OH~6e-~3Cl2,所以n(CH3OH)=
+6H2O。据电子守恒则有CH3OH~6e-~3Cl2,所以n(CH3OH)=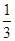 n(Cl2)=0.5 mol,m(CH3OH)=0.5 mol×32 g·mol-1=16 g。
n(Cl2)=0.5 mol,m(CH3OH)=0.5 mol×32 g·mol-1=16 g。

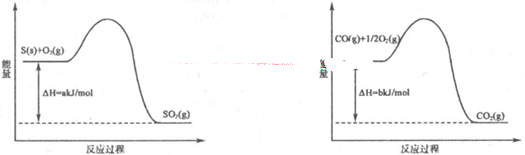
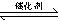 2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是:
2CO2(g)+N2(g),已知该反应在570K时的平衡常数为1×1059,但反应速率极慢。下列说法正确的是: 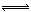 N2(g)+CO2(g)
N2(g)+CO2(g) 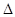 H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下:
H=akJ·mol-1,向某密闭容器加入一定量的活性炭和NO,恒温(T1℃)条件下反应,反应进行到不同时间测得各物质的浓度如下: