从化工厂铬渣中提取硫酸钠的工艺如下:
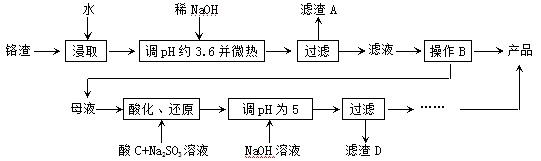
已知:①铬渣含有Na2SO4及少量Cr2O72-、Fe3+;②Fe3+、Cr3+完全沉淀(c ≤1.0×10-5mol·L-1)时pH分别为3.6和5。
(1)“微热”除能加快反应速率外,同时还可以 ,滤渣A为 (填化学
式)。
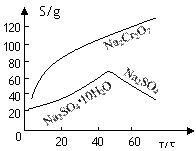
(2)根据溶解度(S)∽温度(T)曲线,操作B的最佳方法为 (填
字母序号)
A.蒸发浓缩,趁热过滤 B.蒸发浓缩,降温结晶,过滤
(3)酸化后Cr2O72-可被SO32-还原成Cr3+,离子方程式为:
;酸C为 ,Cr(OH)3的溶度积常数Ksp[Cr(OH)3]= 。
(4)根据2CrO42-+2H+  Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。
Cr2O72-+H2O设计图示装置(均为惰性电极)电解Na2CrO4溶液制取Na2Cr2O7,图中右侧电极连接电源的 极,其电极反应式为 。

(1)促进Fe3+水解生成Fe(OH)3而除去;Fe(OH)3
(2)A
(3)3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;H2SO4;1.0×10-32mol/L
(4)正极 ,4OH--4e-=O2+2H2O
(1)盐类的水解反应是吸热反应,所以微热能促进Fe3+水解生成Fe(OH)3而除去,A为Fe(OH)3;
(2)根据溶解度曲线,可以看出温度较高时,随着温度的升高,Na2SO4的逐渐减少,所以采用蒸发浓缩,趋热过滤的方法,所以A正确;
(3)酸化后,3SO32-+Cr2O72-+8H+=2Cr3++3SO42-+4H2O;因为最终产品是Na2SO4,为避免产生杂质,酸C为���酸;恰好完全沉淀时离子深度为c ≤1.0×10-5mol·L-1,Cr3+完全沉淀时pH=5,c(OH-)=1.0×10-9mol·L-1,所以Cr(OH)3的浓度积常数为Ksp=1.0×10-5×1.0×10-9)3=1.0×10-32
(4)根据示意图知,图中右侧Na2CrO4转化为Na2Cr2O7,需要H+,说明右侧电极发生OH-放电,使H2O的电离平衡向右移动,H+增多,所以右侧电极是连接电源的正极,电极方程式为4OH--4e-=O2+2H2O
