(17分)I.KNO3俗名硝石,是一种重要的化工原料,在农业上用途十分广泛,下面是一种KNO3制备方法的主要步骤:
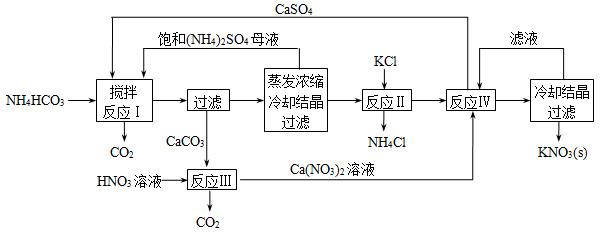
(1)反应Ⅰ中,CaSO4与NH4HCO3的物质的量之比为1︰2,该反应的化学方程式为 。
(2)反应Ⅱ需在干态、加热的条件下进行,加热的目的是 ;从反应Ⅳ所得混合物中分离出CaSO4的方法是 (填“趁热过滤”、“冷却过滤”)。
(3)检验反应Ⅱ所得K2SO4中是否混有KCl的方法是:取少量K2SO4样品溶解于水, 。
(4)整个流程中,可循环利用的物质除(NH4)2SO4外,还有 (填化学式)。
(5)将硝酸与浓KCl溶液混合,也可得到KNO3,同时生成等体积的气体A和气体B。B是三原子分子,B与O2反应生成1体积黄绿色气体A和2体积红棕色气体C。B的分子式为 。
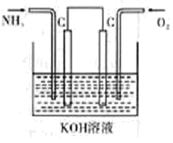
II.(1)工业上可采用电化学的方法获得N2H4,装置如右图所示,则通入氧气的 一极为 (填“正极”、“负极”),NH3反应的电极反应式为 。
(2)肼(N2H4)可以在纯氧中燃烧生成氮气和水,为了充分利用其能量, 有人设计了原电池装置,电极材料是多孔石墨电极,电解质为能够传导H+的固体电解质,请写出负极反应式 。
I.(每空2分)(1)CaSO4+2NH4HCO3=CaCO3↓+(NH4)2SO4+H2O+CO2↑
(2)分离NH4Cl与K2SO4,加快化学反应速率 ; 趁热过滤
(3)加入Ba(NO3)2溶液至不再产生沉淀,静置,向上层清液中滴加AgNO3溶液,若有沉淀生成,说明K2SO4中混有KCl
(4)CaSO4、KNO3
(5)NOCl
II.(1)正极(1分)2NH3—2e‾+2OH‾=N2H4+2H2O(2分)
(2)N2H4—4e‾=N2+4H+(2分)
题目分析:I.(1)根据流程图可知反应物有CaSO4和NH4HCO3、生成物有CaCO3、(NH4)2SO4、CO2、H2O,配平可得化学方程式:CaSO4+2NH4HCO3=CaCO3↓+(NH4)2SO4+H2O+CO2↑
(2)反应Ⅱ生成K2SO4和NH4Cl,所以在干态、加热的条件下进行,有利于分离NH4Cl与K2SO4,加快化学反应速率 ;KNO3的溶解度受温度影响大,温度低时小,为了防止KNO3结晶,提高KNO3的产率,应趁热过滤。
(3)要检验K2SO4中是否混有KCl,需要排除SO42‾的干扰,所以正确方法为:取少量K2SO4样品溶解于水,加入Ba(NO3)2溶液至不再产生沉淀,静置,向上层清液中滴加AgNO3溶液,若有沉淀生成,说明K2SO4中混有KCl,反之,不含KCl。
(4)根据化学流程图,CaSO4、KNO3可循环使用。
(5)B是三原子分子,B与O2反应生成1体积气体A和2体积红棕色气体C,C应为NO2,黄绿色气体应为Cl2,则B中含有N元素和Cl元素,反应的方程式应为2B+O2=Cl2+2NO2,可知B的分子式为NOCl。
II.(1)NH3转化为N2H4,N元素化合价升高,NH3作还原剂,氧气作氧化剂,所以通入氧气的电极为正极;NH3失去电子转化为N2H4,根据化合价的变化配平可得电极方程式:2NH3—2e‾+2OH‾=N2H4+2H2O
(2)肼(N2H4)可以在纯氧中燃烧生成氮气和水,电解质为能够传导H+的固体电解质,所以负极上N2H4失电子生成N2和H+,电极方程式为:N2H4—4e‾=N2+4H+