(15分)氯化亚铜(CuCl)是一种白色固体,微溶于水,不溶于酒精。研究该物质的应用新领域、生产新方法及生产过程中的环保新措施都具有重要意义。
(1)镁—氯化亚铜海水电池,可用于鱼雷上。该电池被海水激活时,正极导电能力增强,同时产生气泡,则正极上被还原的物质有 、 (填化学式)。
(2)工业上以铜作催化剂,氯代甲烷和硅粉反应合成甲基氯硅烷的过程中产生大量废渣(主要成分为硅粉、铜、碳等)。某课外小组以该废渣为原料制CuCl,流程示意图如下:
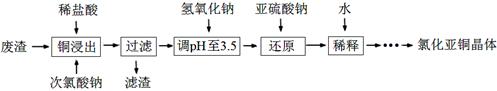
回答下列问题:
①氯代甲烷有4种,其中属于重要工业溶剂的是 (写出化学式)。
②“还原”阶段,SO32-将Cu2+还原得[CuCl2]-,完成下列离子方程式。
 Cu2++
Cu2++ Cl-+
Cl-+ SO32-+
SO32-+ =
= [CuCl2]-+
[CuCl2]-+ +
+
③在稀释过程中存在下列两个平衡:
ⅰ [CuCl2]- CuCl+Cl- K=2.32
CuCl+Cl- K=2.32
ⅱ CuCl(s) Cu+(aq)+Cl- Ksp=1.2×10-6
Cu+(aq)+Cl- Ksp=1.2×10-6
当[CuCl2]-完成转化时(c([CuCl2]-)≤1.0×10-5 mol·L-1),溶液中c(Cu+)≥ 。
④获得CuCl晶体需经过滤、洗涤、干燥。洗涤时,常用无水乙醇代替蒸馏水做洗涤剂的优点是 (写一点)。
(3)工业生产CuCl过程中产生浓度为2~3 g·L-1的含铜废水,对人及环境都有较大的危害,必须进行回收利用。用萃取法富集废水中的铜,过程如下:

①实验室完成步骤ⅰ时,依次在分液漏斗中加入曝气后的废水和有机萃取剂,经振荡并 后,置于铁架台的铁圈上静置片刻,分层。分离上下层液体时,应先 ,然后打开活塞放出下层液体,上层液体从上口倒出。
②写出步骤ⅱ的离子方程式: 。
(1)CuCl、H2O(或H+)(各1分,共2分) (2)①CHCl3或CCl4(任写一个就得分,1分)
②2Cu2++4Cl-+1SO32-+1 H2O =2[CuCl2]-+1 SO42- +2 H+(3分)
③5.17×10-2mol·L-1 (2分) ④避免CuCl溶于水而损失(或其他合理答案)(2分)
(3)①放气(1分) 打开上口玻璃塞(或使塞上的凹槽对准漏斗口上的小孔)(1分)
②R2Cu+2H+=Cu2++2RH(3分)
题目分析:(1)镁是活泼的金属,因此在镁—氯化亚铜海水电池中镁是负极,失去电子,正极得到电子,发生还原反应。该电池被海水激活时,正极导电能力增强,同时产生气泡,该气体应该是氢气,这说明正极上得到电子的物质有CuCl、H2O(或H+)。
(2)①氯代甲烷有4种,其中属于重要工业溶剂的是CHCl3或CCl4。
②根据方程式可知,在反应中铜元素的化合价从+2价降低到+1价,得到1个电子。硫元素的化合价从+4价升高到+6价,失去2个电子,所以根据电子得失守恒可知氧化剂与还原剂的物质的量之比是2:1.根据原子守恒和电荷守恒可知,反应前还有水参加,反应后还有氢离子生成,因此配平后的离子方程式为2Cu2++4Cl-+SO32-+H2O =2[CuCl2]-+SO42- +2H+。
③根据方程式可知K=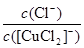 、Ksp=c(Cu+)·c(Cl-),则c(Cu+)=
、Ksp=c(Cu+)·c(Cl-),则c(Cu+)=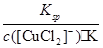 ,因此(c([CuCl2]-)≤1.0×10-5 mol·L-1),溶液中c(Cu+)≥5.17×10-2mol·L-1。
,因此(c([CuCl2]-)≤1.0×10-5 mol·L-1),溶液中c(Cu+)≥5.17×10-2mol·L-1。
④CuCl在有机溶剂中的溶解度小能,用无水乙醇代替蒸馏水可以避免CuCl溶于水而损失。
(3)①在振荡过程中有关随时放气。分液时应该打开上口玻璃塞(或使塞上的凹槽对准漏斗口上的小孔)。
②铜离子与氢离子交换加入水层,因此反应的离子方程式为R2Cu+2H+=Cu2++2RH。
