(12分)含铬化合物有毒,对人畜危害很大。因此含铬废水必须进行处理才能排放。
已知:
(1)在含+6价铬的废水中加入一定量的硫酸和硫酸亚铁,使+6价铬还原成+3价铬;再调节溶液pH在6~8之间,使Fe3+和Cr3+转化为Fe(OH)3、Cr(OH)3沉淀而除去。
①写出Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式 。
②用离子方程式表示溶液pH不能超过10的原因 。
(2)将含+6价铬的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解。阳极区生成的Fe2+和Cr2O72一发生反应,生成的Fe3+和Cr3+在阴极区与OH一结合成氢氧化物沉淀而除去。
①写出阴极的电极反应式 。
②电解法中加入氯化钠的作用是 。
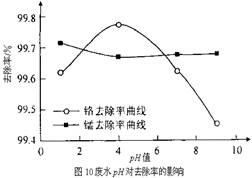
(3)某化学兴趣小组以含+6价铬和+2价锰的工业废水为试样,研究铁屑用量和pH值对废水中铬、锰去除率的影响。
①取100mL废水于250 mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图9所示。则在pH一定时,废水中铁屑用量为
时,锰、铬去除率最好。
②取100mL废水于250 mL三角瓶中,加入规定量的铁粉,调成不同的pH值。得到pH值对铬和锰去除率的影响如下图10所示。则在铁屑用量一定时,废水pH= 时锰、铬去除率最好。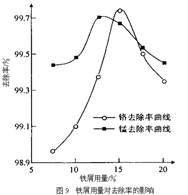
每空2分,共12分
(1)①Cr2O72― + 6 Fe2+ + 14H+= 2Cr3+ + 6Fe3+ + 7H2O
②Cr(OH)3 + OH-= CrO2- + 2H2O
(2)①2H+ + 2e―= H2↑或2H2O + 2e―= H2↑ + 2OH― ②增强溶液导电性
(3)①15% ②4
(1)①Cr2O72―与FeSO4溶液在酸性条件下反应的离子方程式
Cr2O72― + 6 Fe2+ + 14H+= 2Cr3+ + 6Fe3+ + 7H2O
②Cr(OH)3 + OH-= CrO2- + 2H2O
(2)阴极:2H+ + 2e―= H2↑或2H2O + 2e―= H2↑ + 2OH―(2分)
(副反应:Fe3++3OH―="Fe" (OH)3↓
Cr3++3OH―="Cr" (OH)3↓
阳极:Fe―2e―=Fe2+
Cr2O72― + 6 Fe2+ + 14H+= 2Cr3+ + 6Fe3+ + 7H2O
所以答案为①2H+ + 2e―= H2↑或2H2O + 2e―= H2↑ + 2OH― ②增强溶液导电性
(3)读图9:废水中铁屑用量为15%时,锰、铬去除率最好。由图10看出:在铁屑用量一定时,废水pH=4时锰、铬去除率最好。
