(16分)某强酸性溶液X含有Ba2+、Al3+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、Cl-、NO3-中的一种或几种,取该溶液进行连续实验,实验内容如下:
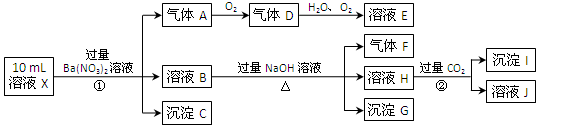
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子是 ,不能确定是否含有的离子(Q)是 ,若要确定该Q(若不止一种,可任选一种)不存在,最可靠的化学方法是 。
(2)沉淀G的化学式为 。
(3)写出有关离子方程式:①中生成A 。
② 。
(4)假设测定A、F、I均为0.01mol,10mL X溶液中n(H+)=0.04mol,当沉淀C物质的量(填“<”、“=”或“>”某个值) ,表明Q离子一定是 。(若不止一种可能,填对一种情况即可)
(16分)(1)Al3+、NH4+、Fe2+、SO42-; Fe3+ 、Cl-;
取少量X溶液放在试管中,加入几滴KSCN,溶液不变红色说明无Fe3+;或者取少量B溶液放在试管中,加入几滴AgNO3溶液,无白色沉淀说明无Cl-(只要答对一种即可得分,但必须强调取X溶液或B溶液,没取或取错不得分) (其它合理答案也可)
(2)Fe(OH)3
(3)3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O; AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
(4)>0.07mol,Fe3+或者<0.07mol,Cl-(只要写出一种即可得分)
强酸性溶液,所以一定没有CO32-、SO32-。气体A应该是NO,所以D是NO2,E是硝酸。这说明溶液中应该含有还原性离子,所以一定含有Fe2+。C是硫酸钡沉淀,则溶液中含有SO42-,所以没有Ba2+。B和氢氧化钠反应,有F气体生成,所以一定含有NH4+。沉淀G是氢氧化铁,溶液H和CO2反应,又产生沉淀,则沉淀应该是氢氧化铝,所以溶液中含有Al3+。其中Fe3+、Cl-无法确定。
(1)检验铁离子一般用KSCN溶液,氯离子一般用硝酸银溶液。
(4)A、F、I均为0.01mol,则根据方程式3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O可知,亚铁离子是0.03mol。氨气是0.01mol,则NH4+是0.01mol。氢氧化铝是0.01mol,则Al3+是0.01mol。如果氢离子是0.04mol,溶液中阴离子只有SO42-,则根据电荷守恒可知,SO42-的物质的量是0.07mol。沉淀C是硫酸钡,所以如果硫酸钡的物质的量大于0.07mol,则溶液中一定含有铁离子;如果小于0.07mol,则一定含有氯离子。
