(14分)(Ⅰ)A、B、C三种无色可溶性盐分别是由Na+、Ag+ 、Ba2+、Cl—、NO3— 、CO32—中不同的阴、阳离子所组成。经实验A溶液、B溶液均可以与盐酸反应,其中A产生白色沉淀,B产生气泡。则A为 、B为 。将B和C的溶液混合反应的化学方程式为: 。
(Ⅱ)有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验:
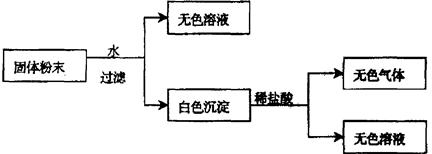
从实验可以判断,该固体粉末中一定不含有 ,
它的组成可能是 或 。
(14分)(Ⅰ) AgNO3 Na2CO3 BaCl2+Na2CO3=BaCO3 ↓+2NaCl
(Ⅱ)CuSO4 CaCO3、Na2SO4、KNO3 CaCO3、KNO3、BaCl2
题目分析:(Ⅰ)B溶液产生气泡,所以B中含有CO32-,所以B是碳酸钠;A溶液产生白色沉淀,所以A中含有银离子,则A应该是硝酸银,所以C是氧化钡。则B和C反应的方程式是BaCl2+Na2CO3=BaCO3 ↓+2NaCl。
(Ⅱ)固体溶于水是无色溶液和白色沉淀,所以一定没有硫酸铜;由于白色沉淀能溶于盐酸中生成无色气体和无色溶液,所以白色沉淀不是硫酸钡,而是碳酸钙,而硫酸钠和氯化钡不能同时存在,由于该物质是由三种物质组成的,是由其起组成可能是CaCO3、Na2SO4、KNO3 、CaCO3、KNO3、BaCl2。
点评:进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。
