(6分)今有一无色的混合物的水溶液,只可能含有以下离子中的若干种:K+、Al3+、Fe3+、Mg2+、Ba2+、 、Cl-
、Cl- 、
、 ,现取两份100 mL溶液进行如下实验:①第一份加过量NaOH溶液加热后,只收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。③第二份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65 g。根据上述实验回答:
,现取两份100 mL溶液进行如下实验:①第一份加过量NaOH溶液加热后,只收集到气体0.02 mol,无沉淀生成,同时得到溶液甲。②在甲溶液中通入过量CO2,生成白色沉淀,沉淀经过滤、洗涤、灼烧,质量为1.02 g。③第二份加足量BaCl2溶液后,得白色沉淀,沉淀经足量盐酸洗涤、干燥后,质量为11.65 g。根据上述实验回答:
(1)一定不存在的离子是________________
(2)不能确定是否存在的离子是
(3)试确定K+是否存在________(填“是”或“否”),判断的理由是
(6分,每小题2分)
(1)Fe3+ Mg2+ Ba2+ CO32- (2)Cl—
(3) 是 溶液中肯定存在的离子是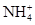 、Al3+、SO42-。经计算,
、Al3+、SO42-。经计算,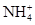 、Al3+物质的量都是0.02 mol,SO42-物质的量是0.05 mol..根据电荷守恒,K+一定存在
、Al3+物质的量都是0.02 mol,SO42-物质的量是0.05 mol..根据电荷守恒,K+一定存在
原溶液无色,可排除Fe3+的存在;
加入过量NaOH溶液加热后,收集到的气体必定为氨气:NH4++OH-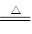 NH3↑+H2O,其物质的量为0.02mol,同时无沉淀生成说明原溶液中不可能含有Mg2+
NH3↑+H2O,其物质的量为0.02mol,同时无沉淀生成说明原溶液中不可能含有Mg2+
甲溶液中通入过量CO2,生成白色沉淀,则可知原溶液中含有Al3+:Al3+4OH-=AlO2-+2H2O、AlO2-+CO2+2H2O=Al(OH)3↓+HCO3—、2Al(OH)3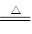 Al2O3+3H2O,由Al2O3的质量为1.02 g,可得原溶液中Al3+的物质的量为0.02mol;由于Al3+的存在,同时可否定了CO32-的存在(双水解反应);
Al2O3+3H2O,由Al2O3的质量为1.02 g,可得原溶液中Al3+的物质的量为0.02mol;由于Al3+的存在,同时可否定了CO32-的存在(双水解反应);
原溶液中加足量BaCl2溶液后,得白色沉淀且不溶于盐酸,可知原溶液中含有SO42-(同时也就排除了Ba2+存在的可能性):SO42-+Ba2+=BaSO4↓,其质量为11.65 g,可求得原溶液中的SO42-物质的量是0.05 mol。
综合以上信息,仍旧不能确定是否存在的离子是Cl—,根据电荷守恒可知必定含有K+
