问题
选择题
已知:HCO3—+AlO2—+H2O=Al(OH)3↓+CO32—某溶液中可能含有OH−,CO32−,AlO2−,SiO32−,SO42−,K+,Na+,Fe3+,Mg2+,Al3+等离子,当向溶液中逐滴加入一定物质的量的盐酸时,生成沉淀物质的量与加入盐酸体积的关系如图所示,下列说法中不正确的是
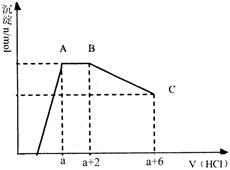
A.原溶液肯定含有OH−,CO32−,AlO2−,SiO32−
B.K+和Na+至少含有其中一种
C.n(CO32−):n(AlO2−)=3:2
D.a值肯定大于4/3
答案
答案:C
根据图像可知,最初没有沉淀,说明一定含有OH−,则一定没有Fe3+,Mg2+,Al3+,所以K+和Na+至少含有其中一种。沉淀达到最高后,又减少,这说明一定有氢氧化铝和硅酸沉淀。因此必须含有AlO2−, SiO32−,所以AB正确。A到B是和CO32−,消耗盐酸是2体积。B到C是溶解氢氧化铝,消耗盐酸是6体积,所以n(CO32−):n(AlO2−)=1︰2,C不正确。由于溶解氢氧化铝消耗盐酸6体积,则生成氢氧化铝消耗盐酸2体积,所以D正确,答案选C。

