某乙醇燃料电池工作时的装置如图所示,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少.
请回答下列问题:
(1)M电极名称是______;N极的电极反应式为______,加入乙醇的铂电极的电极反应式为______.
(2)在此过程中,乙池中某一电极析出金属银4.32g时,甲池中理论上消耗氧气______L(标准状况下);若此时乙池溶液的体积为400mL,则乙池中溶液的pH为______.
(3)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,表示该反应的热化学方程式为______.
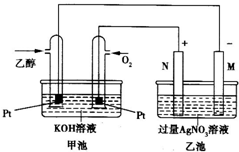
碱性乙醇电池为原电池,通入乙醇的电极是负极,通入氧气的电极是正极,乙池有外接电源,属于电解池,根据图片知,N是阳极,M是阴极,工作时M、N两个电极的质量都不减少,则M电极是铁,N电极是石墨,
(1)通过以上分析知,M是阴极,N极是阳极,N上电极反应式为4OH--4e-=O2↑+2H2O,乙醇电极上乙醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:C2H5OH-12e-+16OH-=2CO32-+11H2O,
故答案为:阴极,4OH--4e-=O2↑+2H2O,C2H5OH-12e-+16OH-=2CO32-+11H2O;
(2)n(Ag)=
=0.04mol,根据Ag++e-=Ag可知转移电子为0.04mol,4.32g 108g/mol
甲池中通入氧气的一极为正极,反应式为2O2+8H++8e-=4H2O,则消耗n(O2)=
×0.04mol=0.01mol,1 4
V(O2)=0.01mol×22.4L/mol=0.224L;
乙池中某一电极析出金属银4.32g时,同时产生氢离子的物质的量是0.04mol,则其浓度是0.1mol/L,所以溶液的pH=1,故答案为:0.224,1;
(3)1g C2H5OH燃烧生成CO2和液态H2O时放出29.71kJ热量,则1mol乙醇燃烧放出的热量=
=1366.66kJ,所以其热化学反应方程式为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.66kJ/mol,29.7kJ 1g 46g/mol
故答案为:C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l)△H=-1366.66kJ/mol.
