如图是甲醇--空气电池工作时的示意图.甲醇在催化剂作用下提供质子(H+) 和电子,电子经外电路、质子经内电路到达另一极与氧气反应.下列说法中正确的是( )
A.正极反应式为:2H++2e-=H2↑
B.乙电极为电池的负极,b处通入的物质是空气
C.负极反应式为:CH3OH+H2O-6e-=CO2+6H+
D.在电池反应中,每消耗lmol氧气,理论上能生成标准状况下CO2气体22.4L
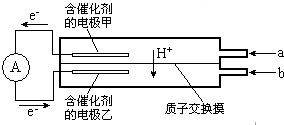
该燃料电池的本质为:2CH3OH+3O2=2CO2+4H2O,所以电池总反应式为:2CH3OH+3O2=2CO2+4H2O,CH3OH发生氧化反应,应在负极通入;O2发生还原反应,应在正极通入.电子从甲电极流出,经外电路流入乙电极,所以甲电极为负极,乙电极为正极;
A、正极电极反应式为:3O2+12H++12e-=6H2O,故A错误.
B、甲电极为负极,故B错误.
C、电池总反应式减去正极电极反应式即为负极电极反应式,即:2CH3OH+2H2O-12e-=2CO2+12H+,故C正确.
D、由池总反应式为:2CH3OH+3O2=2CO2+4H2O,可知,每消耗lmol氧气,理论上能生成标准状况下CO2气体22.4L×
=14.9L,故D错误.2 3
故选C.
