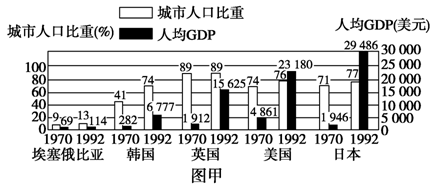
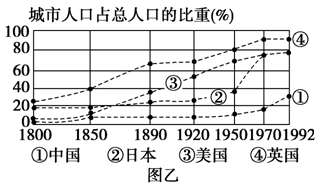
(10分)
(1)① 写出Na2SO4的电离方程式 。
② 氧化铝和氢氧化钠溶液反应的离子反应方程式 。
③ OH- + H+ ="=" H2O改写为化学方程式 。
(2)粗盐中含可溶性CaCl2、MgCl2及一些硫酸盐,除去这些杂质的试剂可选用,①Na2CO3、②NaOH、③BaCl2、④HCl ,用序号表示加入的先后顺序是 。
(3)下列实验操作中不正确的是 (多选)。
A.用分液的方法分离水和汽油的混合物
B.用过滤的方法分离饱和食盐水与沙子的混合物。
C.蒸馏时,应使温度计水银球插入液面以下
D.蒸发结晶时应将溶液蒸干后再停止加热E.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出
(1)①(2分) Na2SO4 = 2Na++ SO42-
②(2分)Al 2 O 3+ 2OH- = 2AlO2- + H2O
③(2分)H2SO4 + 2NaOH = 2H2O + Na2SO4 (其它答案合理也给分)
(2)(2分) ②③①④ 或 ③②①④
(3)(2分) C D
题目分析:(1)Na2SO4属于强电解质,可以完全电离,方程式的书写时用等号表示;
(2)NaOH用来除去钙离子,BaCl2用来除去硫酸根离子,NaOH、BaCl2加入的顺序可以调换,而Na2CO3④用来除去钡离子,必须放在BaCl2之后,而HCl用来除去碳酸根离子和多余的碱,必须放在最后。
(3)A.水和汽油不互溶,可以用分液的方法分离,正确;
B.用过滤的方法分离饱和食盐水与沙子的混合物,正确;
C.蒸馏时,应使温度计水银球的顶部应和蒸馏头侧管的下限在同一水平线上,主要观测液体蒸馏温度。C项错误;
D.蒸发结晶时一般不蒸干,余热可以把剩下的水蒸干,节省能量,又防止过热后飞溅,如果蒸干的话,杂质也会跟着析出,从而降低纯度,有的物质温度过高时会受热分解,D项错误;
E.分液时,分液漏斗下层液体从下口放出,上层液体从上口倒出,正确。
故选CD。
点评:本题考查离子反应的知识,主要考查离子方程式的书写,物质的分离,除去杂质等离子反应的应用,难度不大。