(14分)(1)向1 L AlCl3和FeCl3混合溶液中加入含a mol NaOH的溶液时,产生的沉淀量可达最大值;继续加入NaOH溶液,沉淀开始溶解,当前后加入的NaOH总量达到b mol时,沉淀不再减少,则原溶液中Fe3+的物质的量浓度为 ,AlCl3的物质的量 。
(2)已知:2Fe3++2I- = 2Fe2++ I2; 2Fe2++Br2 = 2Fe3++2Br-
①向含有1mol FeI2和1.5mol FeBr2的溶液中通入2mol Cl2,此时被氧化的离子是 。
②如果向①的溶液中通入3mol Cl2,则被氧化的离子对应的氧化产物分别是 。
(3)①若m g铁屑与含有 n gHNO3的硝酸溶液恰好完全反应,若 m : n =" 1" : 2.7, 该反应的化学方程式为 __________________________________________________(假设还原产物只有一种,且只生成一种盐)
②若含 n g HNO3的稀硝酸溶液恰好使5.6g铁粉完全溶解,若有 n/4 gHNO3被还原成NO(无其它还原产物)则 n 的范围为_________________________
③某条件下锌和硝酸反应时的物质的量之比为2:5,此时硝酸的还原产物是____________
(14分)(1)(4a-3b )/3;b-a (2) ①I- Fe2+ ② Fe3+ I2 Br2
(3)① 5Fe +12HNO3=5Fe(NO3)2 + N2↑ + 6H2O ②16.8 ≤ n ≤ 25.2 ③N2O或NH4NO3
题目分析:(1)设AlCl3和FeCl3的物质的量分别是x和y,则根据有关反应的化学方程式是AlCl3+3NaOH=Al(OH)3↓+3NaCl、FeCl3+3NaOH=Fe(OH)3↓+3NaCl、Al(OH)3+NaOH=NaAlO2+2H2O可知,3x+3y=amol、x=bmol-amol,解得y=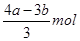 ,所以铁离子的浓度是
,所以铁离子的浓度是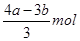 /L。
/L。
(2)①根据氧化还原反应中还原剂的还原性强于还原产物的可知,还原性强弱顺序是I->Fe2+>Br-。2mol氯气得到4mol电子,1mol FeI2失去3mol,所以氯气还能氧化1mol亚铁离子。
②3mol氯气得到6mol电子,溶液中碘离子生成2mol电子,亚铁离子失去2.5mol,所以还能氧化1.5mol溴离子,即氧化产物是Fe3+、I2、Br2。
(3)①铁和硝酸的物质的量之比是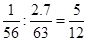 ,所以氧化产物应该是硝酸亚铁,则反应的化学方程式是5Fe +12HNO3=5Fe(NO3)2 + N2↑ + 6H2O。
,所以氧化产物应该是硝酸亚铁,则反应的化学方程式是5Fe +12HNO3=5Fe(NO3)2 + N2↑ + 6H2O。
②硝酸和铁反应的化学方程式可能是Fe+4HNO3=Fe(NO3)3+NO↑+2H2O、3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O。由于反应中有1/4的硝酸被还原,所以根据铁是0.1mol可知,硝酸的最小值和最大值分别是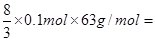 16.8g和
16.8g和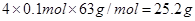 ,则n的取值范围是16.8 ≤ n ≤ 25.2。
,则n的取值范围是16.8 ≤ n ≤ 25.2。
③设锌的物质的量是2xmol,则硝酸是4xmol,生成硝酸锌是2xmol,所以没有被还原的硝酸是4xmol,则被还原的硝酸是5xmol-4xmol=xmol,根据电子的得失守恒可知,硝酸在反应中得到4个电子,即还原产物是N2O;另外如果没有被还原的硝酸并没有全部和锌离子结合生成硝酸锌,则也可能生成硝酸铵,此时反应的化学方程式就是4Zn+10HNO3=4Zn(NO3)2+NH4NO3+3H2O,因此正确的答案是N2O或NH4NO3。
点评:该题难度较大,侧重考查学生的能力和综合素质,对学生的计算能力提出了更高的要求。该题有利于培养学生严谨的逻辑思维能力、发散思维能力以及灵活应变能力,有利于提高学生的学习效率和应试能力以及分析问题、解决问题的能力,增强学生的学习自信心。
