铬的化合物有毒,由于+6价Cr的强氧化性,其毒性是+3价Cr毒性的100倍。因此,必须对含铬的废水进行处理。目前研究和采用的处理方法主要有:
方法一、还原法:
(Ⅰ)在酸性介质中用FeSO4、NaHSO3等将+6价Cr还原成+3价Cr。具体流程如下:
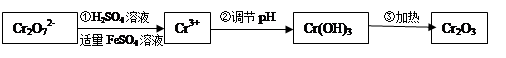
请回答下列问题:
(1)上述流程①发生反应的离子方程式是 。
(2)若在① 使FeSO4适当过量、空气适量,可产生具有磁性、组成类似于铁氧体(Fe3O4或FeO·Fe2O3)的复合氧化物(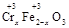 ·y
·y O)(注:X可以是分数),变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物(
O)(注:X可以是分数),变废为宝。则控制空气适量的目的是 ,使铁氧体分离出来较简便的方法是 。假设处理含1 mol Cr2O72-的废水至少需要加入10mol FeSO4·7H2O则复合氧化物(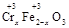 ·y
·y O)化学式是 。
O)化学式是 。
(Ⅱ)研究发现,用铁粉作还原剂不仅可以除去Cr6+,还能除去废水中的少量Mn2+,现研究铁屑用量和pH值对废水中铬、锰去除率的影响,
(3)取100mL废水于250 mL三角瓶中,调节pH值到规定值,分别加入不同量的废铁屑.得到铁屑用量对铬和锰去除率的影响如下图1所示。则在pH一定时,废水中铁屑用量为 时锰、铬去除率最好
(4)取100mL废水于250 mL三角瓶中,加入规定量的铁粉,调成不同的pH值。得到pH值对铬和锰去除率的影响如下图2所示。则在铁屑用量一定时,废水pH= 时锰、铬去除率最好


方法二、电解法:将含+6价Cr的废水放入电解槽内,用铁作阳极,加入适量的氯化钠进行电解:阳极区生成的Fe2+和Cr2O72-发生反应,生成的Fe3+和Cr3十在阴极区与OH一结合生成Fe(OH)3和Cr(OH)3沉淀除去。
(5)写出此阴极反应的电极方程式 。
(6)现用上法处理1×104 L含铬(+6价)78 mg / L的废水,电解时阳极物质消耗的质量至少为________kg。
(16分)(1)Cr2O72-+14H++6Fe2+=6Fe3++2Cr3十+7H2O(2分))

(2)使溶液中的比例恰当(答防止Fe2+被氧气过度氧化可以给分)(2分)
用磁铁吸引(2分) Cr0.5Fe1.5O3·FeO(2分)
(3)15% (2分)(4) 4 (2分)(5)2H2O+2e-=H2↑+2OH-。 (2分) (6) 2.52 (2分)
题目分析:(1)Cr2O72-有较强氧化性,FeSO4中Fe2+有一定的还原性,在酸性介质中发生氧化还原反应,由实验流程可知,第①步反应中Cr2O72-在酸性条件下将Fe2+氧化为Fe3+,自身被还原为Cr3+,根据守恒元素守恒及所处环境可知,还应有水生成,反应离子方程式为Cr2O72-+14H++6Fe2+=2Cr3++6Fe3++7H2O。
(2)空气中含有氧气,如果空气过量,则Fe2+被氧气过度氧化,使溶液中Fe2+和Fe3+的比例不恰当。由于铁氧体具有磁性,所以使铁氧体分离出来较简便的方法是用磁铁吸引。根据反应的离子方程式可知,1mol Cr2O72-能氧化6mol亚铁离子,同时生成2mol Cr3十,而剩余亚铁离子的物质的量是4mol,所以根据原子守恒和化合价代数和为0可知,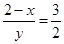 、3x+6-3x+2y=8,解得x=0.5、y=1,所以复合氧化物的化学式是Cr0.5Fe1.5O3·FeO。
、3x+6-3x+2y=8,解得x=0.5、y=1,所以复合氧化物的化学式是Cr0.5Fe1.5O3·FeO。
(3)根据图1知,当铁用量逐渐增大时,离子的去除率先增大后减小,当废水中铁屑用量为15%时锰、铬去除率最好。
(4)根据图2知,当溶液的pH值逐渐增大时,锰离子的去除率先减小后增大,铬的去除率先增大后减小,当pH=4时锰、铬去除率最好。
(5)电解池中阴极得到电子,则阴极是水电离出的氢离子得到电子,所以阴极反应的电极方程式2H2O+2e-=H2↑+2OH-。
(6)1×104 L含铬(+6价)78 mg / L的废水中铬元素的质量是78 mg / L×10000=780000mg=780g,物质的量是780g÷52g/mol=15mol。在反应中得到15mo×3=45mol电子,因此根据电子的得失守恒可知,参加反应的亚铁离子是45mol,所以阳极消耗铁的质量至少是45mol×56g/mol=2520g=2.52kg。
点评:本题以工业废水处理为载体,考查氧化还原反应、离子反应、电极反应式的书写以及有关计算等,难度中等,关键根据实验流程利用氧化还原反应判断发生的离子反应,是对学生综合能力的考查.是一道不错的能力考查题,有利于培养学生的逻辑推理能力和发散思维能力,也有助于培养学生的环境保护意识,提升学生的学科素养。
