(13分)1 000 mL某待测液中除含有0.2 mol·L-1的Na+外,还可能含有下列离子中的一种或多种:
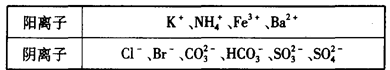
现进行如下实验操作(每次实验所加试剂均过量):
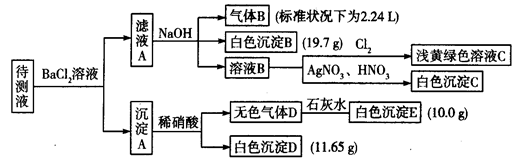
(1)写出生成白色沉淀B的离子方程式:___________________________________。
(2)待测液中肯定不存在的阳离子是_________________。
(3)若无色气体D是单一气体:
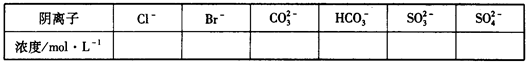
①将阴离子的物质的量浓度填入下表中(一定不存在的填“0”,不能确定的填“?”):
②判断原溶液中K+是否存在,若存在,求其物质的量浓度的最小值,若不存在,请说明理由:________________________________________________________________。
(4)若无色气体D是混合气体:
①待测液中一定含有的阴离子是____________________________。
②沉淀A中能与稀硝酸反应的成分是______________________________(写化学式)。
(13分)
(1)HCO3-+OH-+Ba2+=BaCO3↓+H2O (2分)
(2)Fe3+、Ba2+(2分)
(3)①(3分)
| 阴离子 | Cl- | Br- | CO32- | HCO3- | SO32- | SO42- |
| 浓度/mol·L-1 | ? | 0 | 0.1 | 0.1 | 0 | 0.05 |
②存在,其最小物质的量浓度为0.1mol·L-1((2分)
(4)①CO32、-HCO3-、SO32-(2分)②BaCO3、BaSO4(2分)
题目分析:由实验操作加入BaCl2得到的沉淀A加入硝酸得到白色沉淀D为BaSO4其物质的量为0.05mol,证明原溶液中至少含有SO32-和SO42-中一种,原溶液中无Ba2+,同时得到的无色气体能和石灰水反应得到白色沉淀无色气体中应哈有CO2,其物质的量为0.1mol证明溶液中有CO32-其物质的量为0.1mol且Ba2+不存在。加入NaOH溶液后得到白色沉淀,可知溶液中无Fe3+;可知气体B为NH3其物质的量为0.1mol,故溶液中含NH4+其物质的量为0.1mol,加白色沉淀B应为BaCO3,可知溶液中应含HCO3-其物质的量为0.1mol。溶液B中通入氯气得到浅黄绿色溶液,故原溶液中无Br-(1)反应的离子方程式为:HCO3-+OH-+Ba2+=BaCO3↓+H2O;(3)若无色气体D为单一气体,则D为CO2,则原溶液中有SO42-无SO32-;由以上分析可知,Na+物质的量浓度为0.2 mol·L-1、NH4+其物质的量浓度为0.1mol·L-1、CO32-物质的量浓度为0.1 mol·L-1、HCO3-物质的量浓度为0.1 mol·L、SO42-物质的量浓度为0.05 mol·L-1、Br-物质的量浓度为0 mol·L-1、Cl-物质的量浓度由K+的浓度确定,故是未知;根据电荷守恒,若溶液中无Cl-则K+的物质的量浓度为0.1mol·L-1若含有Cl-则K+的物质的量浓度最小为0.1mol·L-1(4)若无色气体D为混合气体则阴离子一定有CO32、-HCO3-、SO32-。
