某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2—、MnO4—、CO32—、SO42—、SiO32—中的若
干种组成(不考虑水的电离)。取该溶液进行如下实验:
Ⅰ.取适量溶液,加入过量的盐酸,有气体生成,并得到无色溶液;
Ⅱ.在Ⅰ所得溶液中加入过量的NH4HCO3溶液,有气体生成,同时析出白色沉淀甲;
Ⅲ.在Ⅱ所得溶液中加入过量的Ba(OH)2溶液,加热,也有气体生成,同时析出白色沉淀乙。
请回答下列问题:
(1)由实验Ⅰ可知原溶液中一定不含有的离子是________;一定含有的离子是________________。
(2)由实验Ⅱ可知原溶液中还一定含有的离子是________;生成甲的离子方程式为________________。
(3)实验Ⅲ中生成白色沉淀乙的离子方程式为________________。
(4)原溶液中还可能存在的离子是________;检验该离子的方法是_________________。
(1)MnO4—、SiO32—、Ag+、Ba2+、Al3+ CO32—、Na+
(2)AlO2— 3HCO3—+Al3+=Al(OH)3↓+3CO2↑
(3)2OH-+NH4++HCO3—+Ba2+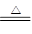 BaCO3↓+NH3↑+2H2O
BaCO3↓+NH3↑+2H2O
(4)SO42— 取白色沉淀乙少许,放入试管中,加入过量的稀盐酸或稀硝酸,若仍有部分白色沉淀不溶解,则证明原溶液中有SO42—;若白色沉淀全部溶解,则证明原溶液中无SO42—
加入过量的盐酸,有气体生成,并得到无色溶液,可知溶液中一定不含有离子MnO4—、SiO32—,一定含有离子CO32—。有CO32—,就一定不含Ag+、Ba2+、Al3+,由于溶液呈电中性,可知溶液中一定含有离子Na+。在Ⅰ所得溶液中加入过量的NH4HCO3溶液,有气体生成,同时析出白色沉淀Al(OH)3,它是AlO2—与过量的盐酸反应生成的Al3+与HCO3—双水解得到的,故原溶液中一定还含有AlO2—。
