某小组查文献得知:氧化性I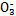 >Fe3+>I2,3Br2+6FeCl2
>Fe3+>I2,3Br2+6FeCl2 2FeBr3+4FeCl3;I2+2S2
2FeBr3+4FeCl3;I2+2S2
 S4
S4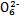 +2I-;CuI是一种白色沉淀(Ksp=1.3×1
+2I-;CuI是一种白色沉淀(Ksp=1.3×1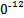 )。
)。
Ⅰ.该小组为确定一份加碘盐(可能含有KIO3、KI、Mg2+、Fe3+)的成分,设计定性实验加以猜想和验证。
(1)实验过程如下:
| 实验步骤 | 实验过程和现象 | 对应结论 | |
| 步骤1 | 取一定量碘盐,用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份 | _____________ | |
| 步 骤 2 | 第①份 试液 |  | 碘盐中肯定含 |
| 第②份 试液 | 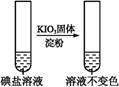 | _____________ | |
| 第③份 试液 | 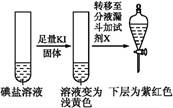 | X为 (填化学式) | |
(2)该碘盐中肯定不含的物质是 (用化学式或离子符号表达)。
(3)根据信息推断Fe3+、S4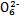 、I2、Br2的氧化性由强到弱的顺序是 。
、I2、Br2的氧化性由强到弱的顺序是 。
(4)第③份试液中加入足量KI固体后,反应的离子方程式为 、 。
Ⅱ.用“间接碘量法”测定含有CuCl2·2H2O晶体的试样(不含能与I-发生反应的氧化性杂质)的纯度,过程如下:
取0.40 g试样溶于水,加入过量KI固体,充分反应,生成白色沉淀。加入淀粉作滴定指示剂,用0.100 0 mol·L-1 Na2S2O3标准溶液滴定,到达滴定终点时,消耗Na2S2O3标准溶液20.00 mL。
(1)滴定终点的现象是 。
(2)CuCl2溶液与KI反应的化学方程式为 。
(3)该试样中CuCl2·2H2O的质量分数为 。
Ⅰ.(1)Fe3+ CCl4 (2)KI
(3)Br2>Fe3+>I2>S4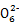
(4)2Fe3++2I- 2Fe2++I2,I
2Fe2++I2,I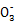 +5I-+6H+
+5I-+6H+ 3I2+3H2O
3I2+3H2O
Ⅱ.(1)蓝色褪去,放置一定时间后不恢复原色(或半分钟内颜色不变化)
(2)2CuCl2+4KI 2CuI↓+I2+4KCl
2CuI↓+I2+4KCl
(3)85.5%
Ⅰ.(2)由步骤②③可知溶液中一定不含KI,结合加碘食盐可知一定含有KIO3;(4)溶液中的Fe3+、I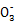 均与I-反应;Ⅱ.依据2CuCl2+4KI
均与I-反应;Ⅱ.依据2CuCl2+4KI 2CuI↓+I2+4KCl、I2+2S2
2CuI↓+I2+4KCl、I2+2S2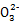
 S4
S4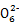 +2I-可知CuCl2~S2
+2I-可知CuCl2~S2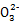 ,n(CuCl2)=n(S2
,n(CuCl2)=n(S2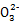 )=2×10-3 mol,m(CuCl2·2H2O)="0.342" g
)=2×10-3 mol,m(CuCl2·2H2O)="0.342" g
