某工厂用软锰矿(含MnO2约70%及Al2 O3)和闪锌矿(含ZnS约80%及FeS)共同生产MnO2,和Zn(干电池原料)。流程如下:
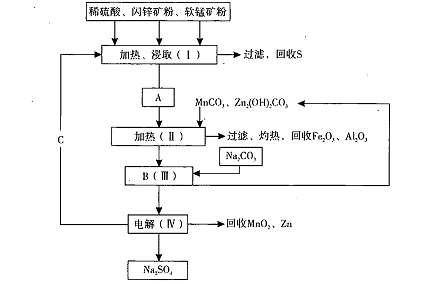
已知:①A是MnSO4、ZnSO4、Fe2(SO4)3,Al2(SO4)3的混合液。
②IV中的电解反应式为MnSO4+ZnSO4+2H2O MnO2+Zn +2H2SO4。
MnO2+Zn +2H2SO4。
(1)A中属于还原产物的是 。
(2)加入MnCO3、Zn2(OH)2CO3的作用是 :C的化学式是 。
(3)该生产中除得到Na2SO4、S等副产品外,还可得到的副产品是 。
(4)副产品S可用于制硫酸,转化过程是:S→SO2→SO3→H2SO4。写出第二步转化的化学方程式 。
(5)要从Na2SO4溶液中得到芒硝( Na2SO4.10H2O),需进行的操作有蒸发浓缩、 、
过滤、洗涤、干燥等。
(6)从生产MnO2和Zn的角度计算,软锰矿和闪锌矿投料的质量比大约是 。
(1)MnSO4
(2)增大溶液的p H,使Fe3+和Al3+生成沉淀 H2SO4
(3)Fe2O3、Al2O3
(4) 2SO2+O2 2SO3
2SO3
(5) 冷却结晶
(6)1:1(或1.03:1)
题目分析:比较信息1可知Mn化合价降低,属于还原产物的为MnSO4,由工艺流程分析加入MnCO3、Zn2(OH)2CO3的作用是增大溶液的p H,使Fe3+和Al3+生成沉淀;且C的化学式为H2SO4;不难得出得到的副产品还有Fe2O3、Al2O3;假设软锰矿和闪锌矿的质量分别为x 、y,根据②可知MnO2和Zn的物质的量之比为1:1,则0.7x g/87g/mol:0.8y g/97g/mol=1:1,解得x/y=1.03:1.
