氢氧燃料电池是符合绿色化学理念的新型发电装置.图为电池示意图,该电池电极表面镀一层细小的铂粉,附气体的能力强,性质稳定,请回答:
(1)氢氧燃料电池的能量转化主要形式是______,在导线中电子流动方向为______(用a、b表示).
(2)负极反应式为______.
(3)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能.因此,大量安全储氢是关键技术之一,金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2
2LiH△ .
Ⅱ.LiH+H2O═LiOH+H2↑
①反应Ⅰ中的还原剂是______,反应Ⅱ中的氧化剂是______.
②已知LiH固体密度为0.82g/cm3.用锂吸收224L(标准状况)H2,生成的LiH体积与被吸收的H2体积比为______.
③由②生成的LiH与H2O作用放出的H2用作电池燃料,若能量转化率为80%,则导线中通过电子的物质的量为______.
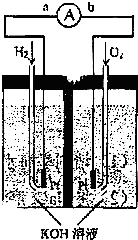
(1)该题目中,氢氧燃料电池的工作原理属于原电池原理,是将化学能转化为电能的装置,在原电池中,电流从正极流向负极,而通入燃料氢气的电极是负极,通氧气的电极是正极,所以电子由a到b,故答案为:化学能转化为电能;由a到b;
(2)燃料电池中,通入燃料氢气的电极是负极,发生失电子的氧化反应,即2H2+4OH--4e-═4H2O或H2+2OH--2e-═2H2O,
故答案为:2H2+4OH--4e-═4H2O或H2+2OH--2e-═2H2O;
(3)①Li从零价升至+1价,作还原剂,H2O的H从+1降至H2中的零价,作氧化剂,故答案为:Li;H2O;
②由反应I,当吸收10molH2时,则生成20molLiH,V=
=m ρ
=197.5×10-3L,20×7.9g 0.82×103L
=V(LiH) V(H2)
=8.82×10-4,故答案为:8.82×10-4;197.5×10-3L 224L
③20molLiH可生成20molH2,实际参加反应的H2为20mol×80%=16mol,1molH2转化成1molH2O,转移2mol电子,所以16molH2可转移32mol的电子,故答案为:32mol.
