问题
不定项选择
如图所示,在真空中A、B两点分别放置等量的异种电荷+q、-q,在通过A、B两点的竖直平面内相对于AB对称取一个矩形路径abcd,且ab平行于AB,a、d到A点的距离等于b、c到B点的距离.设想将一个电子沿路径abcd运动一周,则下列说法正确的是
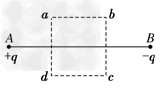
A.由a到b,电势降低,电子的电势能减小
B.由a到b,电势升高,电子的电势能增大
C.由b到c,电场力对电子先做正功,后做负功,总功为零
D.由d到a,电子的电势能先减小后增大,电势能的变化总量为零
答案
答案:D
