(10分)研究NO2、SO2 、CO等大气污染气体的处理具有重要意义。
(1)利用反应6NO2+ 8NH3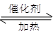 7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
7N2+12 H2O可处理NO2。当转移1.2mol电子时,消耗的NO2在标准状况下是 L。
(2)已知:2SO2(g)+O2(g)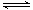 2SO3(g) ΔH=—196.6 kJ·mol-1
2SO3(g) ΔH=—196.6 kJ·mol-1
2NO(g)+O2(g)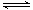 2NO2(g) ΔH=—113.0 kJ·mol-1
2NO2(g) ΔH=—113.0 kJ·mol-1
则反应NO2(g)+SO2(g)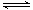 SO3(g)+NO(g)的ΔH= kJ·mol-1。
SO3(g)+NO(g)的ΔH= kJ·mol-1。
(3)铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O= Fe(OH)2+2Ni(OH)2
当电池放电时,正极电极反应式为 。
(共10分)
(1)6.72(3分)
(2)- 41.8(3分)
(3)Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-(4分)
⑴NO2在标准状况下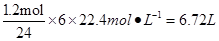
⑵①2SO2(g)+O2(g)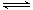 2SO3(g) ΔH=—196.6 kJ·mol-1
2SO3(g) ΔH=—196.6 kJ·mol-1
②2NO(g)+O2(g)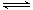 2NO2(g) ΔH=—113.0 kJ·mol-1
2NO2(g) ΔH=—113.0 kJ·mol-1
(①―②)÷2得:(—196.6 kJ·mol-1+113.0 kJ·mol-1)÷2=- 41.8 kJ·mol-1
⑶)Ni2O3+3H2O+2e-=2Ni(OH)2+2OH-
