科学家利用太阳能分解水生成的氢气在催化剂作用下与二氧化碳反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池。已知H2(g)、CO(g)和CH3OH(l)的燃烧热△H分别为-285.8 kJ·mol-1、-283.0 kJ·mol-1和-726.5 kJ·mol-1。请回答下列问题:
(1)用太阳能分解10mol水消耗的能量是_____________kJ;
(2)甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为________________________;
(3)在容积为2 L的密闭容器中,由CO2和H2合成甲醇(CO2+3H2  CH3OH + H2O)
CH3OH + H2O)
在其他条件不变得情况下,考察温度对反应的影响,实验结果如下图所示(注:T1、T2均大于300℃);下列说法正确的是______(填序号)
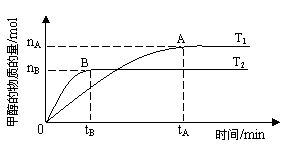
①温度为T1时,从反应开始到平衡,生成甲醇的平均速率为v(CH3OH) =nA/tA mol·L-1·min-1
②该反应在T1时的平衡常数比T2时的小
③该反应为放热反应
④处于A点的反应体系从T1变到T2,达到平衡时n(H2)/n(CH3OH)增大
(4)在T1温度时,将1mol CO2和3mol H2充入一密闭恒容器中,充分反应达到平衡后,若CO2转化率为a,则容器内的压强与起始压强之比为_________________________。
(1)2858 (2)CH3OH(l)+O2(g)===CO(g)+2H2O(l) △H=-443.5kJ/moL
(3)③④ (4)(4-2a):4
(1)氢气的燃烧热是-285.8 kJ·mol,所以1mol水分解需要的能量就是285.8 kJ,则分解10mol水就需要2858 kJ。
(2)根据题意可知,①CH3OH(l)+3/2O2(g)=CO2(g)+2H2O(l) △H=-726.5kJ/moL、②CO(g)+
1/2O2(g)=CO2(g) △H=-283.0kJ/mol,所以①-②即得到CH3OH(l)+O2(g)=CO(g)+2H2O(l),所以反应热是-726.5kJ/moL+283.0kJ/mol=-443.5kJ/moL。
(3)①不正确,因为平衡时甲醇的浓度是nA/2 mol·L-1.T2时首先达到平衡状态,则温度是T2大于T1,温度高甲醇的含量底,说明升高温度平衡向逆反应方向移动,即正反应是放热反应,所以②不正确,③④正确。答案选③④。
(4)CO2转化率为a,则消耗CO2时amol,氢气时3amol,生成甲醇和水蒸气都是amol,所以容器内的压强与起始压强之比为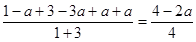 。
。
