问题
选择题
一种新型燃料电池,用两根金属作电极插入KOH溶液中,然后向两极分别
通入甲烷和氧气,其电极反应为X极:CH4+10OH--8e-===CO2+7H2O;Y极:4H2O+2O2+8e-===8OH-。下列关于此燃料电池的说法中,错误的是( )
A.X为负极,Y为正极
B.工作一段时间后,KOH的物质的量减少
C.在标准状况下,通入 5.6 L O2完全反应后,有1 mol电子发生转移
D.该电池工作时,X极附近溶液的碱性增强
答案
答案:D
考查原电池的判断和有关计算。在原电池中负极是失去电子,发生氧化反应的。正极是得到电子,发生还原反应的。甲烷失去电子,被氧化,所以X是负极,Y是正极。将两电极的方程式叠加即得到CH4+2OH-+2O2===CO2+3H2O,因此氢氧化钾是减少的。标准状况下5.6 L O2是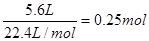 ,所以转移的电子是0.25mol×4=1.0mol。根据X极的电极反应式可知负极X是消耗OH-的,所以碱性是降低的,因此答案选D。
,所以转移的电子是0.25mol×4=1.0mol。根据X极的电极反应式可知负极X是消耗OH-的,所以碱性是降低的,因此答案选D。
