问题
填空题
燃料电池是目前正在探索的一种新型电池。它的工作原理是在燃料燃烧过程中将化学能直接转化为电能,目前已经使用的氢氧燃料电池的基本反应是:X极:O2(g) + 4e- + 2H2O(l) ="==" 4OH-
Y极:H2(g)-2e- + 2OH- ="==" 2H2O(l)
(1)X极是电池的 极(“正”或“负” ),发生 反应(“氧化”或“还原” )反应。
(2)总的电池反应方程式
(3)若反应得到5.4g液态水,燃料电池中转移的电子为 mol
答案
(1)正、还原 (2)2H2 + O2 ="=" 2H2O (3)0.6
(1)在原电池中较活泼的金属作负极,失去电子,发生氧化反应。电子经导线传递到正极上,所以溶液中的阳离子向正极移动,阴离子向负极移动。正极得到电子,发生还原反应。根据方程式可知,氧气得到电子,氢气失去电子,所以X是正极,发生还原反应,Y是负极,发生氧化反应。
(2)正极和负极的电极反应式相加即得到总反应式,即2H2 + O2 ="=" 2H2O。
(3)根据总反应式可知,每生成36g水,反应中就转移4mol电子,所以若反应得到5.4g液态水,燃料电池中转移的电子为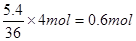 。
。
