请按要求回答下列问题:
(1)新出土的青铜器若保存不善,在潮湿的环境中容易生成铜绿,该腐蚀过程中的负极反应式为:_________________________。
(2)惰性电极电解饱和Na2S溶液时,在阳极附近没有看到预期的浑浊现象,探究发现,其生成了Na2Sx,则阳极反应式为:_____________________。当阳极产生1mol Sx2-时,阴极产生的气体在标准状况下的体积为_________L。(用含x的代数式表示)
(3)合成氨工业中,天然气能代替煤用于生产原料气——H2,且反应类似。请写出天然气转化为H2的两步反应方程式:______________________________________,
___________________________________________。
(4)已知:
| 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
| CH3COOH | 1.8×10-5 | HCN | 5×10-10 |
| H2CO3 | Ka1 = 4.2×10-7 | HClO | 3×10-8 |
| Ka2 = 5.6×10-11 |
②25℃时,0.01 mol/L NaCN溶液的pH________7;
③在浓度均为0.01 mol/L的CH3COONa、NaClO、Na2CO3的混合溶液中,逐滴加入0.01 mol/L HCl,则体系中酸根离子反应的先后顺序为 ;
④25℃时,向20mL 0.1 mol/L CH3COOH溶液中逐滴滴加0.1mol/L NaOH溶液,体系中各种量随着NaOH溶液的加入而变化的图像正确的是_____________。
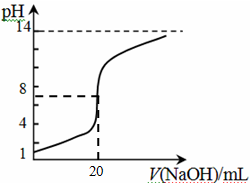
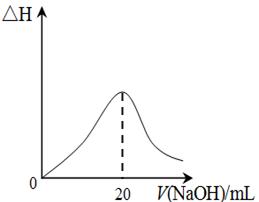
A B
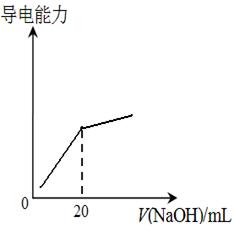
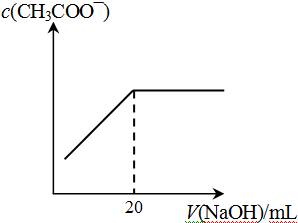
C D
(18分)
(1) Cu - 2e— = Cu2+ (2分)
(2) xS2- - (2x-2) e— = Sx2- ; 22.4(x-1) (各2分)
(3) CH4 + H2O =" CO" + 3H2; CO + H2O = CO2 + H2(各2分)
(4)①CH3COOH;② > ;(各1分)
③CO32—、ClO—、HCO3—、CH3COO—(4分)
④C(2分)
题目分析:(1)铜作为负极失去电子,电极式为:Cu - 2e— = Cu2+。(2)阳极失去电子,发生的是氧化反应,元素的化合价升高,因此电极式为:xS2- - (2x-2) e— = Sx2- ,阳极产生1mol Sx2-时,转移电子数为(2x-2) mol,根据2H++ 2e—=H2↑,计算生成气体的体积为:22.4(x-1)L。(4)电离常数越大,其酸性越强;反之则弱。
点评:本题考查的是电解原理和弱电解质的电离平衡的相关知识,学生要对其原理分析透彻,并利用好题中所给出的信息。
