甲醇(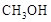 )是重要的能源物质,研究甲醇具有重要意义。
)是重要的能源物质,研究甲醇具有重要意义。
(1)利用工业废气中的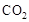 可制取甲醇,其反应为:
可制取甲醇,其反应为: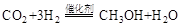
常温常压下已知下列反应的能量变化如图所示:

写出由二氧化碳和氢气制备甲醇的热化学方程式:
。
(2)为提高甲醇燃料的利用率,科学家发明了一种燃料电池,电池的一个电极通入空气,另一个电极通入甲醇气体,电解质是掺入了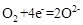 的
的 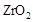 晶体,在高温下它能传导
晶体,在高温下它能传导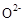 离子。电池工作时正极反应为 。
离子。电池工作时正极反应为 。
若以该电池为电源,用石墨做电极电解100mL含有如下离子的溶液。
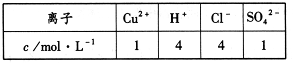
电解一段时间后,当两极收集到相同体积(相同条件)的气体时(忽略溶液体积的变化及电极产物可能存在的溶解现象)阳极上收集到氧气的物质的量为 mol。
(3)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后将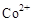 氧化成
氧化成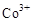 ,然后以
,然后以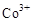 做氧化剂把水中的甲醇氧化成
做氧化剂把水中的甲醇氧化成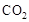 而净化。实验室用下图装置模拟上述过程:
而净化。实验室用下图装置模拟上述过程:
①写出阳极电极反应式 ;
②除去甲醇的离子反应为: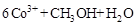
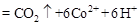 ,该过程中被氧化的元素是 ,当产生标准状况下2.24L
,该过程中被氧化的元素是 ,当产生标准状况下2.24L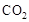 时,共转移电子 mol。
时,共转移电子 mol。
(1)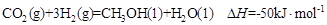 (2分)
(2分)
(2)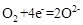 (2分) 0.1(2分)
(2分) 0.1(2分)
(3)①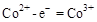 (2分) ②C或碳(2分) 0.6(2分)
(2分) ②C或碳(2分) 0.6(2分)
题目分析:(1)左图中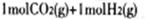 转化为
转化为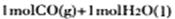 时能量变化为-41 Kl·mol-1,右图中
时能量变化为-41 Kl·mol-1,右图中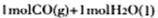 转化为
转化为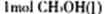 时能量变化为:419 Kl·mol-1—510 Kl·mol-1= -9Kl·mol-1,则由二氧化碳和氢气制备甲醇的能量变化为-41 Kl·mol-1+(-9Kl·mol-1)=—50 Kl·mol-1
时能量变化为:419 Kl·mol-1—510 Kl·mol-1= -9Kl·mol-1,则由二氧化碳和氢气制备甲醇的能量变化为-41 Kl·mol-1+(-9Kl·mol-1)=—50 Kl·mol-1
(2)为提高甲醇燃料的利用率,在燃料电池的一个电极通入空气,此时空气作为正极,而甲醇气体作为负极,正极反应式为: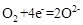 。当两极收集到相同体积(相同条件)的气体时,说明电解过程分别产生了O2、Cl2、H2,则此时阳极上收集到氧气的物质的量为0.1mol。
。当两极收集到相同体积(相同条件)的气体时,说明电解过程分别产生了O2、Cl2、H2,则此时阳极上收集到氧气的物质的量为0.1mol。
(3)由题意,通电后将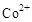 氧化成
氧化成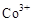 说明
说明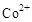 所在的电极为阳极,则阳极反应式为:
所在的电极为阳极,则阳极反应式为: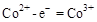 ,CH3OH作为阴极,被氧化,其中被氧化的是甲醇中的C元素,当产生标准状况下2.24L
,CH3OH作为阴极,被氧化,其中被氧化的是甲醇中的C元素,当产生标准状况下2.24L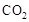 时,说明 * * 生了0.1mol
时,说明 * * 生了0.1mol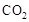 ,则共转移电子0.6 mol。
,则共转移电子0.6 mol。
点评:将有机化合物制作成相应的燃料电池,符合绿色化学与可持续发展理念,此种类型的题目为高考重要考点,体现了化学与生活息息相关,也加强了学生的化学设计与探究意识。
