问题
填空题
理论上讲,任何自发的氧化还原反应都可以设计成原电池.请利用下述反应:Cu+2AgNO3=Cu(NO3)2+2Ag设计一个原电池装置.
(1)画出装置图,并标明电极材料和电解质溶液;
(2)写出电极反应式:
正极:______;
负极:______.
(3)若导线上转移电子0.1mol,则生成银______克.
答案
(1)根据反应方程式知,选铜、银作电极材料,硝酸银溶液作电解质溶液,该装置图为:
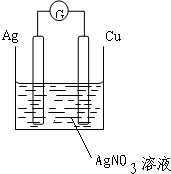
(2)根据电极材料的活泼性判断正负极,较活泼的铜作负极,失去电子变成离子进入溶液,银作正极,银离子得电子生成银单质,故答案为:(+)2Ag++2e-=2Ag,(-)Cu-2e-=Cu2+
(3)Cu+2AgNO3 =Cu(NO3)2 +2Ag 转移电子
(2×108)g 2mol
10.8g 0.1mol
故答案为 10.8
