问题
填空题
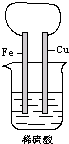
如图所示,将铁、铜通过导线相连,置于稀硫酸中.
(1)铁片上的现象是______,电极反应式______.
(2)铜片上的现象是______,电极反应式______.
(3)写出该电池总反应的离子方程式______.
(4)Fe2+向______(填具体电极)移动,溶液中的pH______(填“变大”或“变小”).
答案
(1)该原电池中,铁的活泼性大于铜,铁作负极,铁失电子变成离子进入溶液,所以铁片逐渐溶解,电极反应式为:Fe-2e-=Fe2+;
故答案为:Fe-2e-=Fe2+.
(2)铜作正极,铜电极上,氢离子得电子生成氢气2H++2e-=H2↑,所以看到的现象是:有大量气泡产生.
故答案为:有大量气泡产生;2H++2e-=H2↑.
(3)正负极上电极反应式相加得电池反应式,所以电池反应式为Fe+2H+=Fe2++H2↑;
故答案为:Fe+2H+=Fe2++H2↑.
(4)该电池外电路上,电子从铁片沿导线流向铜片,所以铜片上有大量电子,根据异性电荷相吸,所以
Fe2+向铜极移动,在铜极上氢离子得电子生成氢气,所以氢离子浓度降低,溶液中的pH变大.
故答案为:变大.
