问题
填空题
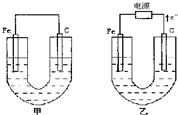
甲、乙两池电极材料如图所示,请按要求回答下列问题:
(1)若两池中均为Cu(NO3)2溶液,反应一段时间后:
①有红色物质析出的是甲池中的______棒(铁、碳);乙池中的______极(阴、阳).
②乙池中阳极上发生的电极反应方程式是______.
(2)若两池中均为饱和NaCl溶液:
①写出乙池中总反应的化学方程式______.
②甲池中碳极上电极反应方程式是______,乙池碳极上电极反应属于______(填氧化反应、还原反应).
答案
甲没有外接电源,所以是原电池,铁作负极,碳作正极;乙有外接电源,所以是电解池,根据电子的流向判断,铁作阴极,碳作阳极;
(1)①甲池中的 正极发生还原反应,有金属析出,所以是碳棒;
乙池中的阴极发生还原反应,有金属析出,所以是铁棒;
故答案为:碳;阴.
②乙池中阳极上发生氧化反应,氢氧根离子的放电能力大于硝酸根离子的放电能力,所以是氢氧根离子失电子生成氧气和水,故答案为:4OH--4e-═O2↑+2H2O
(2)①氯化钠溶液中存在的离子是:氯离子、氢氧根离子、钠离子、氢离子,氯离子的放电能力大于氢氧根离子,氢离子的放电能力大于钠离子,所以该反应的生成物是氯气、氢气、氢氧化钠.
故答案为:2H2O+2NaCl
2NaOH+H2↑+Cl2↑ 电解 .
②在中性溶液中,溶有一定量的氧气,此时会发生吸氧腐蚀,负极上铁失电子,正极上氧气和水得电子生成氢氧根离子,乙池中碳棒作阳极,阳极上发生氧化反应,
故答案为:O2+4e-+2H2O═4OH-;氧化反应,
