(1)我国首创的海洋电池,总反应为:4Al+3O2+6H2O═4Al(OH)3,负极为______,负极发生______反应(填“氧化”或“还原”),负极反应______;正极为铂网,______ (填“电子”或“电流”)从铂极流出;海水为电解质溶液,海水中的Na+移向______ (填“正极”或“负极”).
(2)航天技术使用氢氧电池具有高能、轻便,不污染优点,氢氧燃料电池有酸式和碱式两种,它们放电时的电池总反应式均可表示为:2H2+O2═2H2O.酸式氢氧燃料电池的电解质是酸,其负极反应为:2H2-4e-═4H+,则正极反应为______;碱式氢氧燃料电池的电解质是碱,其正极反应表示为:O2+2H2O+4e-═4OH-,则负极反应为:______.
(3)蓄电池Pb+PbO2+2H2SO4
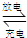
2PbSO4+2H2O放电时,正极电极反应式______,当电路中通过0.5mol电子时,消耗H2SO4的物质的量______,负极增重______g.
(1)根据反应方程式知,活泼的金属作负极,所以负极是Al,负极失电子发生氧化反应;正极为铂网,电子从负极经外电路到正极,电流正好相反,从正极经外电路到负极;正极上聚集大量电子,根据异性相吸,所以钠离子移向正极.
故答案为:Al;氧化;电流;正极.
(2)酸式氢燃料电池的电解质是酸、
电池总反应式均可表示为:2H2+O2=2H2O①
其负极反应为:2H2-4e-=4H+ ②,
则正极反应为 ①-②,即O2+4e-+4H+=2H2O;
碱式氢氧燃料电池的电解质是碱,
其正极反应表示为:O2+2H2O+4e-=4OH-③,
则负极反应为①-③,即2H2-4e-+4OH-=4H2O
故答案为:O2+4e-+4H+=2H2O; 2H2-4e-+4OH-=4H2O
(3)放电时,该装置是把化学能转化为电能,所以是原电池.原电池中正极上得电子发生还原反应,二氧化铅得电子和硫酸根离子、氢离子反应生成硫酸铅和水,所以电极反应式为:PbO2+2e-+SO42-+4H+=PbSO4+2H2O
设消耗硫酸xmol
PbO2+2e-+SO42-+4H+=PbSO4+2H2O 转移电子
Pb+PbO2+2H2SO4
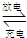
2PbSO4+2H2O 转移电子
2mol 2mol
x mol 0.5mol
所以x=0.5mol.
设负极增重yg.
负极电极反应式为:Pb+SO42--2e-=PbSO4 转移电子 负极增重质量(硫酸铅-铅)
2mol 96g
0.5mol yg
y=24g
故答案为:PbO2+2e-+SO42-+4H+=PbSO4+2H2O;0.5mol;24.
