问题
计算题
一定温度下,难溶电解质在饱和溶液中各离子浓度幂的乘积是一个常数,这个常数称为该难溶电解质的溶度积,用符号Ksp表示。即:AmBn(s)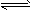 mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
mAn+(aq)+nBm-(aq) [An+]m·[Bm-]n=Ksp
已知:某温度时,Ksp(AgCl)=[Ag+][Cl-] =1.8×10-10 Ksp(Ag2CrO4)=[Ag+]2[CrO42-]=1.1×10-12 试求:此温度下,在0.010mo1·L-1的AgNO3溶液中,AgCl与Ag2CrO4分别能达到的最大物质的量浓度。
答案
解:在0.010 mol·L-1 AgNO3溶液中,c(Ag+)=0.010 mol·L-1
AgCl(s) 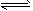 Ag+(aq) + Cl-(aq)
Ag+(aq) + Cl-(aq)
溶解平衡时: 0.010+x x
(0.010+x)·x=1.8×10-10
∵ x很小,
∴ 0.010+x≈0.010
x=1.8×10-8(mol·L-1)
c(AgCl)=1.8×10-8(mol·L-1)
Ag2CrO4(s) 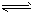 2Ag+(aq) + CrO42-(aq)
2Ag+(aq) + CrO42-(aq)
溶解平衡时: 0.010+x x
(0.010+2x)2·x=1.1×10-12
∵ x很小,
∴ 0.010+2x≈0.010
x=1.1×10-8(mol·L-1)
∴ c(Ag2CrO4)=1.1×10-8 (mol·L-1)
