某课外兴趣小组为了探究碱性溶液中Mg2+、AlO2-与溶液pH的关系,进行下列实验:向含有0.1mol
HCl、0.1mol MgCl2、1.0mol AlCl3的混合溶液中逐渐加入NaOH溶液,均至反应后溶液体积1L。测得部分实验数据如下表
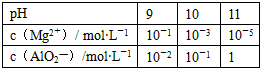
试回答:
(1)向混合溶液中加入NaOH溶液至pH=9,能否有Mg(OH)2沉淀出现__________(填“能”或“否”),由此你得到的初步结论是_______________________________。
(2)向混合溶液中加入NaOH溶液至pH=10,需要NaOH溶液中有多少克NaOH?(最后结果保留两位小数)
(1)否;Mg2+在弱碱性溶液中不能生成沉淀或Mg(OH)2存在溶解平衡
(2)pH=10时,溶液中c(Mg2+)=10-3mol/L,c(AlO2-)=0.1 mol/L 向混合溶液中加入NaOH溶液反应过程分为三个阶段:
H+ + OH- = H2O
0.1mol 0.1mol
Mg2+ + 2OH- =Mg(OH)2↓
0.099mol 0.198mol
Al3+ + 3OH- = Al(OH)3↓
1mol 3mol
Al(OH)3 + OH- =AlO2-+2H2O
0.1mol 0.1mol
根据反应方程式计算,NaOH的质量为(0.1mol+0.198mol +3mol +0.1mol)×40g/mol=135.92g
