问题
填空题
Al(OH)3为两性氢氧化物,在水溶液中存在酸式电离和碱式电离两种形式,试根据平衡移动反应物质,解释下列有关问题。
(1)向Al(OH)3沉淀中加入盐酸,沉淀溶解,其原因是_________________,有关离子方程式是___________________。
(2)向Al(OH)3沉淀中加入苛性钠溶液,沉淀溶解,其原因是__________________,有关离子方程式是______________________。
答案
(1)Al(OH)3的碱式电离为Al(OH)3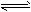 Al3++3OH-,加入盐酸溶液,由于H+与Al(OH)3电离出来的少量
Al3++3OH-,加入盐酸溶液,由于H+与Al(OH)3电离出来的少量
OH-中和生成水,使Al(OH)3的电离平衡向电离方向移动;Al(OH)3+3H+==Al3++3H2O
(2)Al(OH)3的酸式电离为Al(OH)3+H2O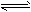 H++[Al(OH)4]-,当向Al(OH)3沉淀中加入碱溶液时,OH-与
H++[Al(OH)4]-,当向Al(OH)3沉淀中加入碱溶液时,OH-与
H+反应生成水,Al(OH)3的酸式电离平衡向正方向移动;Al(OH)3+OH-==[Al(OH)4]-


