问题
填空题
试利用平衡移动原理解释下列事实:
(1) FeS不溶于水,但能溶于稀盐酸中:____。
(2) CaCO3难溶于稀硫酸,却能溶于醋酸中:____。
(3)分别用等体积的蒸馏水和0.010mol/L硫酸洗涤BaSO4沉淀,用水洗涤造成BaSO4的损失量大于用稀硫酸洗涤的损失量:___。
答案
(1) FeS (s)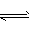 Fe2+ (aq)+S2- (aq),加入稀盐酸后,S2 - +2H+=H2S↑,破坏了FeS的溶解平衡,使上述平衡向正方向移动,故FeS能溶于稀盐酸
Fe2+ (aq)+S2- (aq),加入稀盐酸后,S2 - +2H+=H2S↑,破坏了FeS的溶解平衡,使上述平衡向正方向移动,故FeS能溶于稀盐酸
(2) CaCO3(s)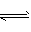 CO32- (aq)+ Ca2+ ( aq),在稀硫酸中生成的CaSO4微溶,附着在CaCO3的表面,很难破坏CaCO3的溶解平衡,故难溶于稀H2SO4。而在醋酸中,CO32- +2CH3COOH
CO32- (aq)+ Ca2+ ( aq),在稀硫酸中生成的CaSO4微溶,附着在CaCO3的表面,很难破坏CaCO3的溶解平衡,故难溶于稀H2SO4。而在醋酸中,CO32- +2CH3COOH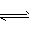 2CH3COO-+H2O+CO2↑,破坏了CaCO3的溶解平衡,故CaCO3能溶于醋酸
2CH3COO-+H2O+CO2↑,破坏了CaCO3的溶解平衡,故CaCO3能溶于醋酸
(3) BaSO4(s)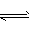 Ba2+ ( aq)+SO42- (aq),用水洗涤使 BaSO4的溶解平衡向正方向移动,造成BaSO4的损失;而用 H2SO4洗涤,H2SO4=2H++SO42- ,SO42-的存在抑制了BaSO4 的溶解,故BaSO4损失较少
Ba2+ ( aq)+SO42- (aq),用水洗涤使 BaSO4的溶解平衡向正方向移动,造成BaSO4的损失;而用 H2SO4洗涤,H2SO4=2H++SO42- ,SO42-的存在抑制了BaSO4 的溶解,故BaSO4损失较少
