问题
填空题
如图:横坐标为溶液的pH,纵坐标为Zn2+离子或Zn(OH)42-离子物质的量浓度的对数,回答下列问题:
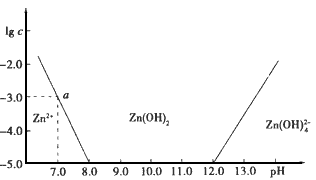
(1)往ZnCl2溶液中加入足量的氢氧化钠溶液,反应的离子方程式可表示为____
(2)从图中数据计算可得Zn(OH)2的溶度积(Ksp)=____。
(3)某废液中含Zn2+离子,为提取Zn2+离子可以控制溶液中pH的范围是____
(4)往1L1.00 mol·L-1 ZnCl2溶液中加入NaOH固体至pH=6,需NaOH ____ mol(精确到小数点后2位)。
(5)25℃时,PbCl2固体在盐酸中的溶解度如下: 根据上表数据判断下列说法正确的是____。

A.随着盐酸浓度的增大,PbCl2固体的溶解度先变小后又变大
B.PbCl2固体在0.50 mol·L-1盐酸中的溶解度小于在纯水中的溶解度
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
答案
(1)Zn2+ +4OH-=[Zn(OH)4]2-
(2)10-17
(3)8.0~12. 0
(4)1. 80
(5)ABCD
