(1)碳氢化合物完全燃烧生成CO2和H2O.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol•L-1.若忽略水的电离及H2CO3的第二级电离,请计算可逆反应H2CO3

HCO3-+H+的平衡常数K1.(已知10-5.60=2.5×10-6)
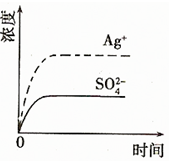
(2)已知Ag2SO4的Ksp 为2.0×10-5,将适量Ag2SO4固体溶于100mL水中至刚好饱和,该过程中Ag+和SO42-浓度随时间变化关系如右图(饱和Ag2SO4溶液中c(Ag+)=0.034mol•L-1).若t1时刻在上述体系中加入100mL 0.020mol•L-1 Na2SO4 溶液,请通过计算说明该溶液中是否有沉淀析出?(写出计算过程,忽略体积变化)
下列示意图中,能正确表示t1时刻后Ag+和SO32-浓度随时间变化关系的是______

(1)根据平衡常数K1=
,c(H+)•c(HCO3-) c(H2CO3)
c(H+)=c(HCO3-)=2.5×10-6mol/L,
c(H2CO3)=1.5×10-5 mol L,
可求 出 K1=4.2×10-7,答:可逆反应H2CO3

HCO3-+H+的平衡常数K1为4.2×10-7;
(2)Ag2SO4刚好为100ml的饱和溶液,因为c(Ag+)=0.034mol•L-1,所以c(SO42-)=0.017mol•L-1;
当加入100ml 0.020mol•L-1Na2SO4溶液后,c(SO42-)=0.0185mol•L-1,c(Ag+)=0.017mol•L-1,
由此可以看出应为B图象,
此时Q<Ksp,则该溶液中没有沉淀析出,
故答案为:B.
