铜及其化合物在工业生产和日常生活中有着广泛的应用。
(1) Li--CuO电池总反应为:2Li + CuO = Li2O + Cu.电解质溶液为高氯酸锂有机溶液,电池的正极反应式为 _____________。
(2) Cu2O是种半导体材料,可在碱性溶液中用电解法制取。电解总反应式为:2Cu + H2O Cu2O + H2↑。阳极反应式为_________;Cu2O投入稀硫酸中,得到蓝色溶液和红色沉淀,写出该反应的离子方程式___________________。
Cu2O + H2↑。阳极反应式为_________;Cu2O投入稀硫酸中,得到蓝色溶液和红色沉淀,写出该反应的离子方程式___________________。
(3)用氯化铁溶液腐蚀印刷电路钢板后的废液中,各金属离子物质的量浓度的对数值随溶液pH的变化如下图所示(当溶液中金属离子浓度≤10–5 mol·L –1时,可认为沉淀完全)。
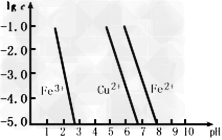
由上图可知Fe(OH)2与Cu(OH)2的溶度积Ksp[Fe(OH)2]________Ksp[Cu(OH)2](填“>”或“<”)。若废液中Cu2+、Fe3+和Fe2+浓度均为0.1 mol/L,向其中通入氨气调节溶液的pH = 5.6时,溶液中存在的金属阳离子为________________。
(4)纳米级铜粉对高氯酸铵的热分解有催化作用,1 mol高氯酸铵分解时除产生2 mol水蒸气和1 mol氧气外,其它组成元素均形成气态单质。该反应的化学方程式为_________________。1 mol高氯酸铵分解所产生的气体有________mol。
(1)CuO – 2e– + 2Li+ = LiO + Cu
(2)2Cu – 2e– + 2OH– = Cu2O + H2O;Cu2O + 2H+ = Cu2+ + H2O
(3) >;Cu2+、Fe2+
(4)2NH4ClO4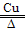 4H2O + 2O2↑ + N2↑ + Cl2↑;4
4H2O + 2O2↑ + N2↑ + Cl2↑;4
