炼锌厂产生的工业废渣--锌渣(除了含Zn外,还含有Fe、Al、Cd和SiO2等杂质),利用锌渣制取并回收ZnSO4•7H2O和金属镉是一个有益的尝试,其流程如下:
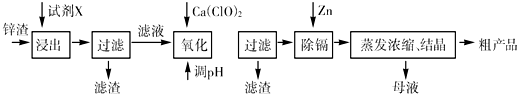
已知:Fe3+、Al3+、Zn2+、Cd2+、Fe2+以氢氧化物完全沉淀时的pH分别为:3.2,4.7,6.5,9.4,9.7
试回答下列问题:
(1)浸出时用到的试剂X为______
(2)写出加入Ca(ClO)2反应的离子方程式______
(3)调节pH过程可以选用______(填“ZnO”或“NaOH”);本流程的pH调节一般调至5,其目的是______
(4)写出过滤后加入过量的锌粉反应的离子方程式______
(5)在蒸发浓缩操作时,要采取实验措施______.
(1)由于是制取硫酸锌晶体的,所以应该用稀硫酸,故答案为:H2SO4溶液;
(2)Ca(ClO)2氧化亚铁离子,由于双氧水的还原产物是水,所以方程式为2H++ClO-+2Fe2+=Cl-+2Fe3++H2O,
故答案为:2H++ClO-+2Fe2+=Cl-+2Fe3++H2O;
(3)不能引入新的杂质,所以选择氧化锌,如加入NaOH,若过量,会导致Zn2+沉淀析出,
故答案为:ZnO;除去Fe3+和Al3+,防止Zn2+沉淀析出;
(4)锌的金属活动性比镉强,,所以要置换出镉,又不能引入杂质,选择锌,反应的离子方程式为Zn+Cd2+=Zn2++Cd,
故答案为:Zn+Cd2+=Zn2++Cd;
(5)要从溶液中得到硫酸锌晶体,应该是通过加热浓缩、蒸发结晶,然后过滤,洗涤即可,为防止硫酸锌水解而生成杂质,应保持一定的酸度,故答案为:保持一定的酸度.
