沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变.已知AgCl+Cl-═[AgCl2]-,如图是某温度下AgCl在NaCl溶液中的溶解情况.
由以上信息可知:
(1)由图知该温度下AgCl的溶度积常数为______.
(2)AgCl在NaCl溶液中的溶解出现如图所示情况(先变小后变大)的原因是:______
(3)设计实验证明S(AgCl)>S(AgI)>S(Ag2S),实验方案是______
(4)若在AgCl形成的浊液中滴加氨水有什么现象?______发生反应的离子方程式为______.
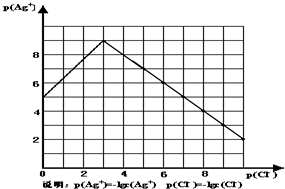
(1)AgCl的溶度积常数Ksp=c(Ag+)•c(Cl-)=10-9mol/L•10-3mol/L=10-12,故答案为:10-12;
(2)根据沉淀溶解平衡:AgCl(s)=Cl-(aq)+Ag+(aq),将氯化银放在氯化钠中,Cl-抑制了AgCl的溶解,但Cl-浓度增大使AgCl形成络合物:AgCl+Cl-═[AgCl2]-,
故答案为:Cl-抑制了AgCl的溶解,但Cl-浓度增大使AgCl形成络合物:AgCl+Cl-═[AgCl2]-;
(3)根据S(AgCl)>S(AgI)>S(Ag2S),并且沉淀向着更难溶的物质转化,可以设计实验方案是:向AgCl悬浊液中滴加KI稀溶液(0.1mol/L),固体由白色转化为黄色,再向悬浊液中滴加同浓度Na2S稀溶液(0.1mol/L),固体由黄色转化为黑色,
故答案为:向AgCl悬浊液中滴加KI稀溶液(0.1mol/L),固体由白色转化为黄色,再向悬浊液中滴加同浓度Na2S稀溶液(0.1mol/L),固体由黄色转化为黑色;
(4)氯化银能和氨水反应生成无色银氨溶液溶液,现象是:白色沉淀溶解,形成无色溶液,
实质为:AgCl+2NH3=Ag(NH3)2++Cl-,
故答案为:白色沉淀溶解,形成无色溶液;AgCl+2NH3=Ag(NH3)2++Cl-.
