取一定量的PbI2固体用蒸馏水配成饱和溶液,量取25.00mLPbI2饱和溶液,分次慢慢加入交换柱,进行如下离子交换反应:Pb2+(aq)+2R-H(s)=R2Pb(s)+2H+(aq),用洁净的锥形瓶接流出液,待溶液流出后,再用蒸馏水淋洗树脂至流出液呈中性,将洗涤液一并放在锥形瓶中,加入指示剂,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL.结合上述实验数据(已知lg2=0.3),下列有关说法正确的是( )
A.常温下,0.0025mol/LNaOH溶液 pH=11.4
B.在温度不变时,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的Ksp减小
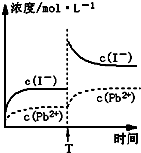
C.温度不变,T时刻,向PbI2饱和溶液中加入少量KI浓溶液,离子浓度变化如图所示
D.本次实验测得的t℃PbI2的Ksp=4×10-9
A、常温下,0.0025mol/LNaOH溶液中c(OH-)=0.0025mol/L;c(H+)=
=4×10-12mol/L; pH=-lg4×10-12mol/L=11.4,故A正确;10-14 0.0025
B、在温度不变时,向PbI2饱和溶液中加入少量硝酸铅浓溶液,PbI2的Ksp不变,故B错误;
C、依据PbI2(s)⇌Pb2++2I-;温度不变,T时刻,向PbI2饱和溶液中加入少量KI浓溶液,平衡左移,平衡后溶液中碘离子浓度增大,铅离子浓度减小,故图象不正确,故C错误;
D、,用0.0025mol/LNaOH溶液滴定,当达到滴定终点时,用去氢氧化钠溶液20.00mL,测得氢离子物质的量为5×10-5mol,依据Pb2+(aq)+2R-H(s)=R2Pb(s)+2H+(aq),计算得到Pb2+物质的量=2.5×10-5mol;n(I-)=5×10-5mol;Ksp=c(Pb2+)×c2(I-)
×(2.5×10-5mol 0.025L
)2=4×10-9 ,故D正确;5×10-5mol 0.025L
故选AD.
