甲、乙两上实验小组分别进行测定Na2CO3和NaC1混合物中Na2CO3含量的实验.
甲组:沉淀分析法(相对分子质量:Na2CO3为106; BaCO3为197; BaCl2为208)
(1)配制一定物质的量浓度的BaC12溶液:用已经称量好的______gBaC12固体配制0.4mol•L-lBaCl2溶液250mL,所需要的仪器为量筒和______.
(2)把m g混合物溶解后加入过量BaC12溶液,然后将所得沉淀过滤、洗涤、烘干、称量,固体质量为wg,根据沉淀质量计算原混合物中Na2CO3的质分数为______(用含m、w的代数式表示).如果原溶液中过量的Ba2+浓度达到0.01mol/L,则溶液中残留的CO32-的物质的量浓度是______.[Ksp(BaCO3)=2.58×10-9]
乙组:气体分析法
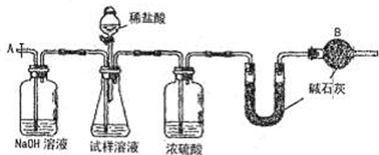
(3)实验中待锥形瓶中不再产生气体后,打开活塞从导管A端缓缓鼓入一定量的空气,这样做的目的是______.
(4)装置中干燥管B的作用是______.
(5)除已理的agNa2CO3样品外,实验中还应测定的数据是______处(填图中仪器的名称)装置实验前后的质量差.
(6)该实验还存在的明显缺陷是______.
(1)BaC12固体的质量m=cVM=0.4mol•L-l×0.25L×208g/mol=20.8g,故答案为:20.8;
溶液配制步骤为:一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水),用玻璃棒搅拌,冷却后转移到250mL容量瓶中,并用玻璃棒引流,洗涤并将洗涤液移入容量瓶中,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加至溶液凹面与刻度线水平相切,盖好瓶塞,摇匀,所以需要的仪器为:托盘天平、药匙、烧杯、筒量(可用、也可不用)、玻璃棒、250ml容量瓶、胶头滴管,故答案为:烧杯、玻璃棒、250ml容量瓶、胶头滴管;
(2)根据题意可知发生的反应为碳酸钠和氯化钡的反应,同时生成碳酸钡的质量为wg,所以可以据此求出碳酸钠的质量,然后得出样品中碳酸钠的质量分数;
设碳酸钠的质量为x
BaCl2+Na2CO3═2NaCl+BaCO3↓
106 197
x wg
=106 x 197 wg
解得:x=106wg 197
所以碳酸钠的质量分数可以表示为:
×100%,106wg 197mg
碳酸钡沉淀的溶度积为Ksp(BaCO3)=2.58×10-9,原溶液中过量的Ba2+浓度达到0.01 mol/L,则溶液中残留的CO32-的物质的量浓度为
=Ksp(BaCO3) C(Ba 2+)
mol/L=2.58×10-7mol/L,2.58×10 -9 0.01
故答案为::
×100%;2.58×10-7mol/L;106wg 197mg
(3)实验中待锥形瓶中不再产生气体后,二氧化碳会滞留在装置中,所以通入空气使产生的二氧化碳全部进入后续的装置,故答案为:使产生的二氧化碳全部进入后续的装置;
(4)空气中的二氧化碳和水可以进入U型管,所以装置中干燥管B的作用是吸收空气中的二氧化碳和水,故答案为:吸收空气中的二氧化碳和水;
(5)实验的原理通过测定二氧化碳的质量来求出碳酸钠的质量,二氧化碳的质量也就是U型管增重的质量,故答案为:U型管;
(6)盐酸具有挥发性,制得的二氧化碳中混有氯化氢,也能被碱石灰吸收,使得二氧化碳的质量偏大,最后结果偏大,故答案为:盐酸具有挥发性,制得的二氧化碳中混有氯化氢,U型管增重的质量偏大,最后结果偏大.
