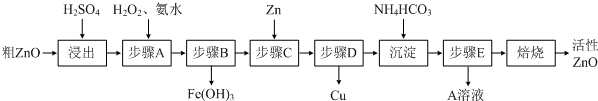
活性ZnO在橡胶、塑料、涂料工业中有重要应用,一种由粗ZnO(含FeO、CuO)制备活性ZnO的流程如下(已知:碱式碳酸锌经焙烧可制得活性ZnO):
已知:几种离子生成氢氧化物沉淀时的pH如下表:
| 待沉淀离子 | Fe2+ | Fe3+ | Zn2+ | Cu2+ |
| 开始沉淀时pH | 6.34 | 1.48 | 6.2 | 5.2 |
| 完全沉淀时pH | 9.7 | 3.2 | 8.0 | 6.4 |
(1)步骤A加H2O2发生反应的离子方程式是______,该步骤需控制溶液pH的范围是______.
(2)A溶液中主要含有的溶质是______.
(3)若经处理后的废水pH=8,此时Zn2+的浓度为______mg/L(常温下,Ksp[Zn(OH)2]=1.2×10-17).
(4)步骤C中加Zn的目的是______.
(1)步骤A加入H2O2的目的是将Fe2+氧化为Fe3+ 便于除去,同时不引入新的杂质,反应的离子方程式为
2Fe2++H2O2+2H+=2Fe3++2H2O,由流程图看出该步操作只生成Fe(OH)3沉淀,结合表中数据可知需控制溶液pH为3.2-5.2之间,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;3.2~5.2;
(2)硫酸锌溶液中加入碳酸氢铵后生成碱式碳酸锌沉淀和硫酸铵,过滤后,得到的滤液溶质主要为(NH4)2SO4,
故答案为:(NH4)2SO4;
(3)由c(Zn2+)×c2(OH-)=1.27×10-17
c(Zn2+)=
mol/L=1.2×10-5mol/L,1.2×10-17 (10-6)2
即1.2×10-5mol•L-1×65g•mol-1=7.8×10-4g/L=0.78mg/L,
故答案为:0.78;
(4)Zn比Cu活泼,可将将Cu2+还原为Cu从而除去Cu2+,故答案为:将Cu2+还原为Cu从而除去Cu2+.

 :
: :2
:2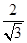 tD
tD