钡盐行业生产中排出大量的钡泥[主要含有BaCO3、BaSiO3、BaSO3、Ba(FeO2)2等.某主要生产BaCl2、BaCO3、BaSO4的化工厂利用钡泥制取Ba(NO3)2,其部分工艺流程如下:
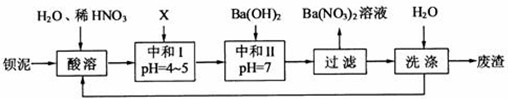
(1)酸溶过程中会产生CO2、硫酸钡、硅酸.
①二氧化碳与水作用形成的碳酸在水中的电离常数Ka1=4.2×10-7,Ka2=5.6×10-11;次氯酸在水中的电离常数Ka=4.7×10-8.写出向“84消毒液”(主要成分为氯化钠和次氯酸钠)中通入二氧化碳发生反应的离子方程式______;
②硫酸钡是重晶石的主要成分.工业上可以用碳来对重晶石进行处理得到BaS,最终转化成BaCl2.
已知:BaSO4(s)+4C(s)═4CO(s)+BaS(s)△H=571.2KJ/mol
BaSO4(s)+2C(s)═2CO2(s)+BaS(s)△H=226.2KJ/mol
则:C和CO2在高温下反应的热化学方程式为:______
(2)酸溶后溶液中pH=1,Ba(FeO2)2与HNO3的反应化学方程式为______.
(3)酸溶时通常控制反应温度不超过70℃,且不使用浓硝酸的原因是______.
(4)该厂结合本厂实际,选用的X为______(填化学式);中和Ⅰ使溶液中______(填离子符号)的浓度减少(中和Ⅰ引起的溶液体积变化可忽略).
(5)上述流程中洗涤的目的是______.
(1)①由电离常数可知酸性:H2CO3>HClO>HCO3-;所以,向次氯酸钠溶液中通入二氧化碳反应的离子方程式为
ClO-+CO2+H2O═HClO+HCO3-,故答案为:ClO-+CO2+H2O═HClO+HCO3-;
②已知:①BaSO4(s)+4C(s)═4CO(s)+BaS(s)△H=+571.2KJ/mol,
②BaSO4(s)+2C(s)═2CO2(s)+BaS(s)△H=+226.2KJ/mol,
利用盖斯定律将
可得:C(s)+CO2(g)═CO(g);①-② 2
△H=
=+172.5kJ/mol,571.2kJ/mol-226.2kJ/mol 2
故答案为:C(s)+CO2(g)═CO(g)△H=+172.5KJ/mol;
(2)Ba(FeO2)2中Fe元素是+3价,故Ba(FeO2)2与硝酸不发生氧化还原反应,其反应方程式为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O,
故答案为:Ba(FeO2)2+8HNO3═Ba(NO3)2+2Fe(NO3)3+4H2O;
(3)酸溶时控制反应温度不超过70℃,是为了防止温度过高,反应速率太快;不使用浓硝酸,是因为浓HNO3不稳定,易分解,易挥发,
故答案为:防止反应速率过快,浓HNO3易挥发、分解;
(4)加入X调节溶液的pH=4~5,则X应能消耗H+,结合工厂主要生产BaCl2、BaCO3、BaSO4的实际情况,可选用BaCO3;中和后溶液中H+浓度减小,pH在4~5时,Fe3+也完全沉淀,故Fe3+浓度也减小,故答案为:BaCO3;Fe3+、H+;
(5)因为钡盐是重金属盐,有毒,故洗涤的目的是减少废渣中可溶性钡盐对环境的污染,
故答案为:减少废渣中可溶性钡盐对环境的污染.
