利用染化厂的废料铁泥(主要成分是Fe2O3、FeO和铁)制备可用于隐形飞机涂层的纳米四氧化三铁的生产流程为图1:
请回答:
(1)过程①主要反应的离子方程式为______.
(2)已知氢氧化亚铁的Ksp=4.87×10-17,氢氧化铁的Ksp=2.6×10-39.当溶液中某离子浓度不高于1×10-5 mol•L-1时,可以认为该离子已经完全沉淀.通过计算所得数据说明过程②调节pH=9的原因是______.
(3)物质D的主要产物中铁、氢、氧三种元素的质量比为56:1:32,则过程③主要反应的化学方程式为______.
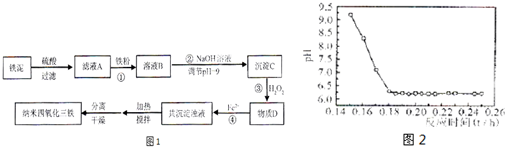
(4)已知Fe2+在弱碱性溶液中还原性较强,图2是研究过程④的实验所得,则该反应所需的时间控制在______小时左右,较为适宜.
(5)某工厂处理废铁泥(测得铁元素含量为16.8%)的能力为10吨/小时,生产纳米四氧化三铁的产量为4.64吨/小时.如不考虑过程④以后生产中Fe2+的氧化,则该工厂每小时消耗铁粉的质量为______千克.
(1)Fe3+与Fe反应生成Fe2+,反应的离子方程式为2Fe3++Fe=3Fe2+,故答案为:2Fe3++Fe=3Fe2+;
(2)根据水的离子积为1×10-14,当pH=9时,OH-的浓度为1×10-4mol•L-1,根据氢氧化亚铁的Ksp=1×10-13,得Fe2+的浓度为5×10-5mol•L-1,
故答案为:当pH=9时,Fe2+的浓度为5×10-5mol•L-1,已完全沉淀;
(3)根据物质D铁、氢、氧三种元素的质量比为56:1:32,则它们的个数比为:1:1:2,故物质D为:FeO(OH),反应的化学方程式为:2Fe(OH)2+H2O2=2FeO(OH)+2H2O,
故答案为:2Fe(OH)2+H2O2=2FeO(OH)+2H2O (物质D写成Fe(OH)O或FeHO2、FeO2H均可以);
(4)Fe2+在弱碱性溶液中还原性较强,因此我们PH值要在酸性或者强碱性,但Ⅰ.工业生产要考虑生产效率,时间越短要好.Ⅱ.碱性(PH>9)太强使Fe2+沉淀,综合考虑最佳反应时间为0.16h,
故答案为:随着反应时间的增加,溶液的PH下降,可确定该反应的最佳时间是0.16h;
(5)处理废铁泥(测得铁元素含量为16.8%)的能力为10吨/小时,计算每1小时处理的废铁泥得到含铁元素质量=16.8%×10吨=1.68吨;生产纳米四氧化三铁的产量为4.64吨/小时,不考虑过程④以后生产中Fe2+的氧化,说明最后得到四氧化三铁中铁元素质量除二价铁离子是加入的,三价铁离子全部来源于加入的铁和铁妮中铁元素的质量,依据铁元素质量守恒计算得到:
每小时生成Fe3O4质量为4.64吨,含三价铁元素质量=4.64吨×
×100%=4.64×2Fe Fe3O4
=2.24吨,所以加入的铁粉质量=2,24吨-1.68吨=0.56吨=560Kg;2×56 232
故答案为:560
