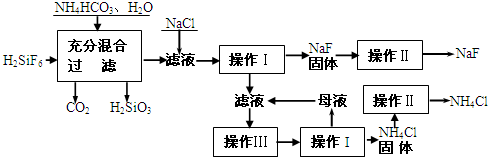
氟化钠是一种重要的氟盐,主要用作农业杀菌剂、杀虫剂、木材防腐剂和生产含氟牙膏等.实验室可通过下图所示的流程以氟硅酸(H2SiF6)等物质为原料制取氟化钠,并得到副产品氯化铵:
有关物质在水中溶解度见下表.请回答下列问题:
| 温度 | 10℃ | 20℃ | 30℃ | 溶解度:20℃NaF-4g;0℃NH4F-100g; 常温Na2SiF6-微溶于水 |
| NH4Cl溶解度 | 33.3g | 37.2g | 41.4g |
(2)上述流程中发生两步化学反应,第一步反应的化学方程式为:______,第二步反应的化学方程式为______.
(3)操作II的作用是______;操作Ⅲ的具体过程是______.
(4)流程中NH4HCO3必须过量,其原因是______.
(5)NaF可用于生产含氟牙膏,使用含氟牙膏可以预防龋齿.请说明含有NaF的牙膏如何将羟基磷酸钙[Ca5(PO4)3(OH)]转化为更难溶的氟磷酸钙[Ca5(PO4)3F]______.
(1)操作Ⅰ是过滤操作,用到的玻璃仪器包括烧杯、玻璃棒、漏斗,故答案为:漏斗;
(2)第一步反应的方程式,反应物有H2SiF6、和NH4HCO3,生成物有H2SiO3、CO2,根据质量守恒还应有NH4F,则反应的化学方程式为H2SiF6+6NH4HCO3=6NH4F+H2SiO3↓+6CO2↑+3H2O,第二步反应是将第一步生成的NH4F转化为NaF,加入的反应物为NaCl,利用了物质在溶液中溶解度越小则优先析出的特性,所以NaF比NaCl的溶解性小,反应的化学方程式为
NH4F+NaCl=NH4Cl+NaF↓,
故答案为:H2SiF6+6NH4HCO3=6NH4F+H2SiO3↓+6CO2↑+3H2O;NH4F+NaCl=NH4Cl+NaF↓;
(3)操作Ⅱ是将粗NaF洗涤除去其表面的杂质,以得到纯净的NaF,操作Ⅲ是将滤液中的溶质进一步提取,故操作是加热蒸发溶剂,析出大量固体后冷却,
故答案为:除去NaF、NH4Cl 表面的杂质;蒸发浓缩溶液,析出多量固体后冷却;
(4))流程中NH4HCO3必须过量,是指第一步操作中必须保证H2SiF6能全部反应,以防止生成Na2SiF6沉淀,影响制取物质的纯度,
故答案为:保证H2SiF6能全部反应;防止在加入NaCl后H2SiF6与NaCl反应生成Na2SiF6沉淀混入NaF中影响NaF纯度;
(5)从沉淀平衡移动的角度分析,Ca5(PO4)3F的溶解度小于Ca5(PO4)3(OH),羟基磷酸钙在水中存在溶解平衡:
Ca5(PO4)3(OH)⇌5Ca2++3PO43-+OH-,当F-与Ca2+、PO43-结合生成了更难溶于水的Ca5(PO4)3F,使沉淀平衡向右移动,属于沉淀的转化问题.
故答案为:羟基磷酸钙在水中存在溶解平衡:Ca5(PO4)3(OH)⇌5Ca2++3PO43-+OH-,当F-与Ca2+、PO43-结合生成了更难溶于水的Ca5(PO4)3F,使上述平衡中Ca2+和PO43-减少而向右移动,继续生成更多的Ca5(PO4)3F,难溶物发生了转化.
