利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
已知:SO2+
O2⇌SO3△H=-98KJ•mol-11 2
(1)在T1温度时,该反应的平衡常数K=
,若在此温度下,向100L的恒容密闭容器中,充入3.0molSO2、16.0molO2和3.0molSO3,则反应开始时正反应速率______逆反应速率(填“<”、“>”或“=”).10 3
(2)在T2温度时,开始在100L的密闭容器中加入4.0molSO2和10.0molO2,一定条件下当反应达到平衡时共放出热量196kJ.此时二氧化硫的转化率为______.
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2平衡浓度比原来减小的是______(填字母).
A.保持温度和容器体积不变,充入1.0molO2
B.保持温度和容器内压强不变,充入2.0molSO2和5.0molO2
C.降低温度
D.在其他条件不变时,减小容器的容积
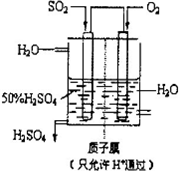
(4)有人设想以如图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:______.
(5)由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时,
=______.[已知该温度时,KSP(BaSO4)=1.3×10-10,KSP(BaCO3)=5.2×10-9].c(C
)O 2-3 c(S
)O 2-4
(1)SO2+
O2⇌SO3△H=-98KJ•mol-1,向100L的恒容密闭容器中,充入3.0molSO2、16.0molO2和3.0molSO3,1 2
因为浓度商QC=
=c(SO3) c(SO2)[c(O2)] 1 2
=2.5>K,所以化学反应正向进行,即v(正)>v(逆),故答案为:>; 3.0mol 100L
×(3.0mol 100L
)16.0mol 100L 1 2
(2)在T2温度时,开始在100L的密闭容器中加入4.0molSO2和10.0molO2,一定条件下当反应达到平衡时共放出热量196kJ根据1molSO2完全反应放热98KJ;则一定条件下当反应达到平衡时共放出热量196kJ,消耗二氧化硫物质的量=
=2mol;依据化学平衡三段式列式计算:1mol×196KJ 98KJ
SO2(g)+
O2(g)⇌SO3(g)1 2
开始量(mol) 4 10 0
变化量(mol) 2 1 2
平衡量(mol) 2 9 2
所以SO2的转化率α=
×100%=50%,故答案为:50%; 2mol 4mol
(3)A、保持温度和容器体积不变,O2的浓度增大,平衡正向移动,SO2的浓度减小,所以A正确;
B、保持温度和容器内压强不变,充入2.0molSO2和5.0molO2,新的平衡与原平衡等效,SO2的浓度不变,所以B错误;
C、降低温度,平衡向放热的方向移动,而正反应为放热,所以平衡正向移动,SO2的浓度减小,所以C正确;
D、在其他条件不变时,减小容器的容积,SO2的浓度瞬间增大,之后平衡向气体体积减少的方向移动,即向正反应方向移动,SO2的浓度减小,再次到达平衡时SO2的浓度仍比原来大,所以D错误.
故答案为:A、C;
(4)依据图装置分析,二氧化硫失电子发生氧化反应,二氧化硫被氧化为三氧化硫溶于水生成硫酸;电极反应为:SO2+2H2O=SO42-+4H++2e-;
故答案为:SO2+2H2O=SO42-+4H++2e-;
(5)在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时,依据溶度积常数可知沉淀向硫酸钡沉淀分析转化,BaCO3+SO42-=BaSO4+CO32-;结合碳酸钡和硫酸钡溶度积常数;
=c(CO22-) c(SO42-)
=Ksp(BaCO3) Ksp(BaSO4)
=40;5.2×10-9 1.3×10-10
故答案为:40;
